こんにちは!この記事を書いてるKenだよ。浮き足立ってるね。
中1理科の「身のまわりの物質」という単元では、色々な実験をやっていくけど、中でも興味深くて面白いのが、
アンモニアの噴水実験
という実験だ。
これは簡単にいうと、
アンモニア(気体)が入ったフラスコに水をちょっと入れると、下から水が吸い上げられれて噴水みたいに溢れ出る
っていう実験だ。
今日は、このアンモニア噴水実験の手順と、なぜ、このような噴水現象が起きるのかという原理、仕組みまでみていこう。
まずはアンモニアの噴水実験で必要な実験器具をみていこう。
この実験では、
が必要になってくるよ。
アンモニアの噴水実験で使う実験器具は下の図のようになるね。
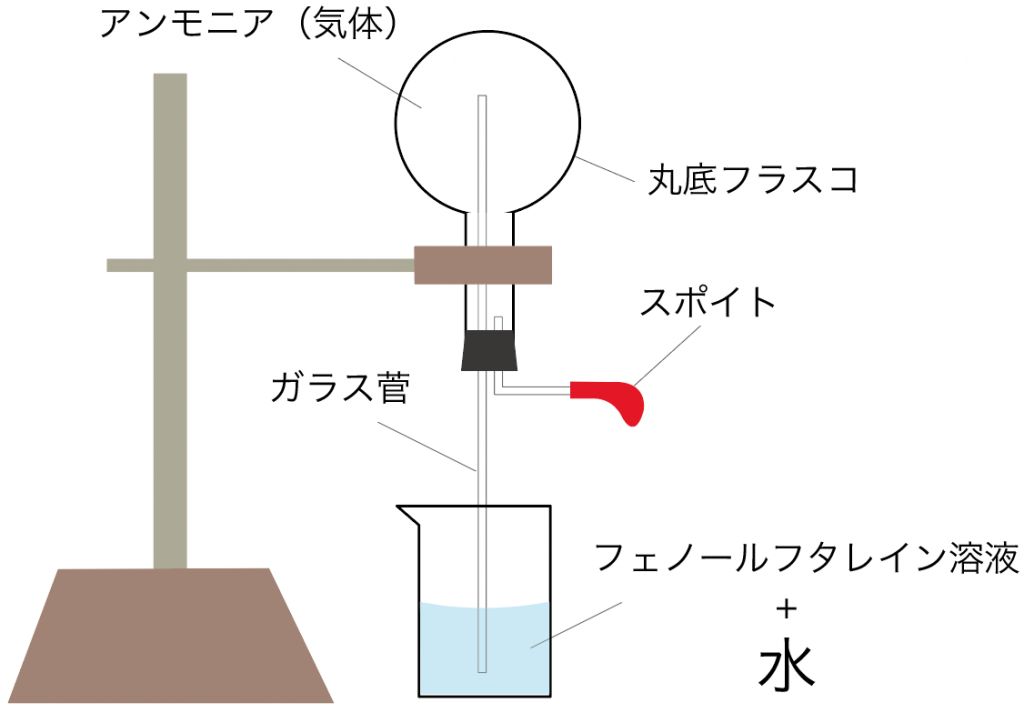
アンモニアの噴水実験の手順は次の4ステップを踏むといいよ。
まずは噴水実験で使うアンモニアの気体を、丸底フラスコに集めてみよう。
上方置換法
を使うんだったね。
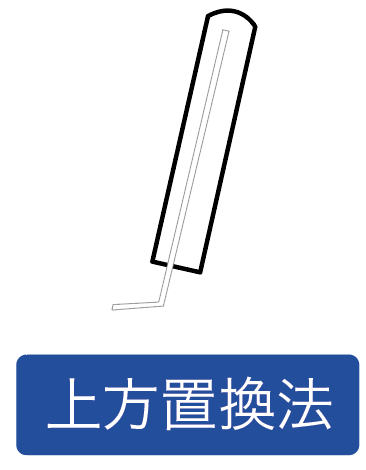
水に溶けやすくて、密度が空気より小さいアンモニアはこの方法で集めるのが鉄則だ。
丸底フラスコいっぱいに気体のアンモニアを集めたら準備完了ね。
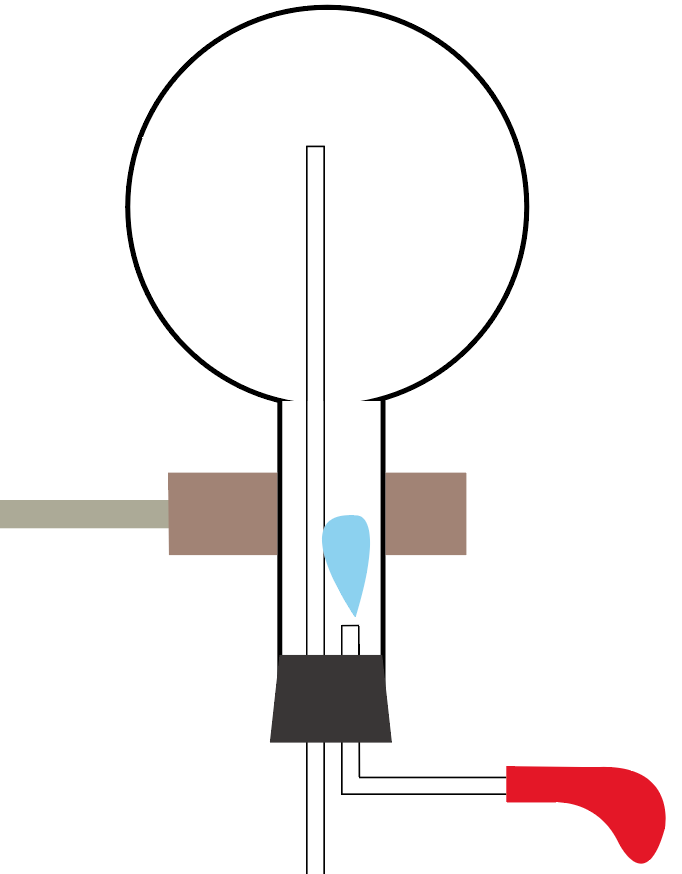
丸底フラスコに、気体のアンモニアを注入し終わったら実験器具をセッティングしてみよう。

スポイトには水をいれておいてね。
それじゃあ、スポイトで丸底フラスコに水を入れてみよう。
ぴゅっと水をたらせばいいんだ、ぴゅっと。
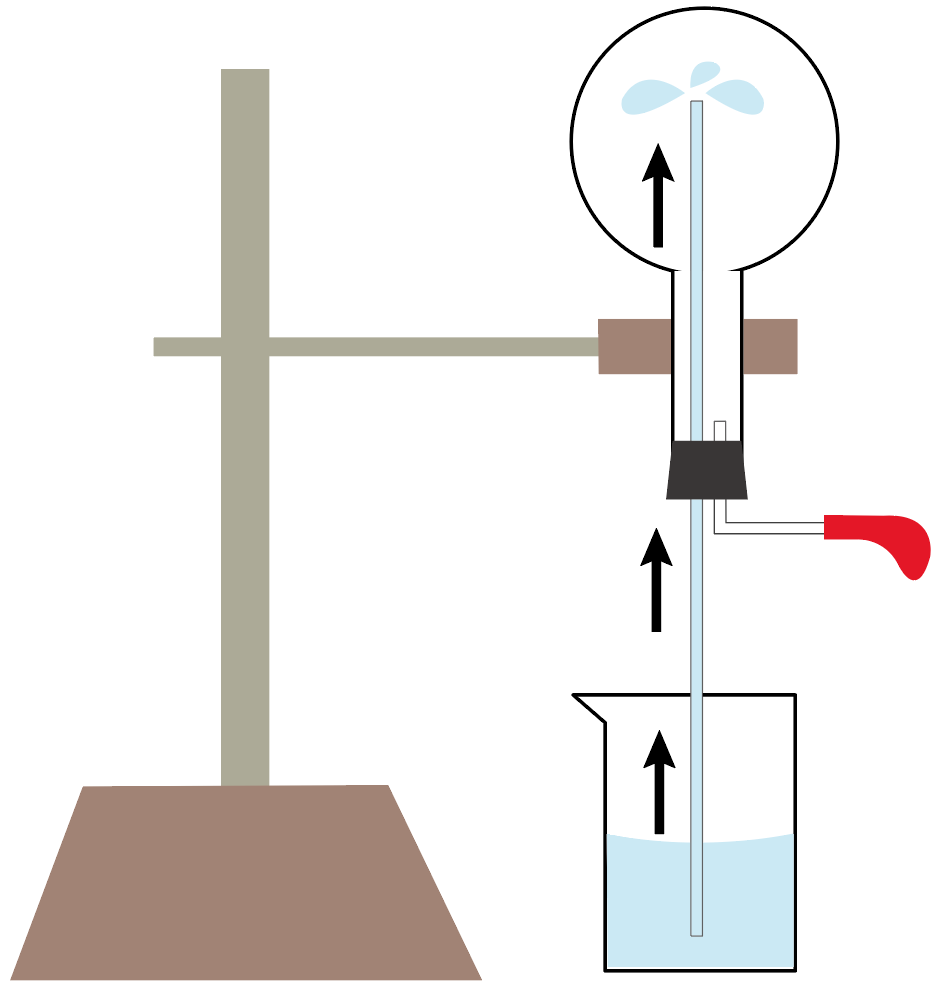
すると、どうだろう??
丸底フラスコの下にセットしていた水(フェノールフタレイン溶液入り)が、ガラス管を伝って、ぐんぐん丸底フラスコに吸い上げられていくではないか。
ガラス管を伝って、丸底フラスコに溢れ出たフェノールフタレイン溶液入りの水は、すぐに変色。
透明だったフェノールフタレイン溶液が、赤色に変化するね。
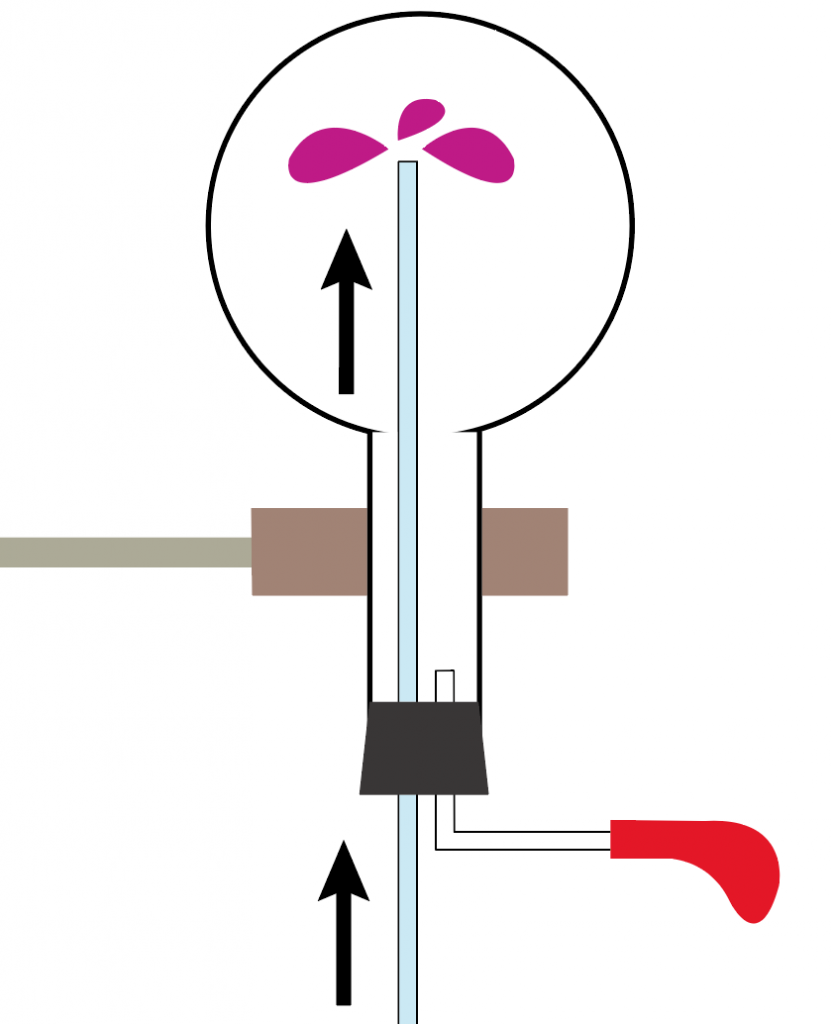
ってことで、こんな感じで、ガラス管から溢れ出だフェノールフタレイン溶液入りの水が、変色しながら丸底フラスコの中に溜まっていくわけだ。
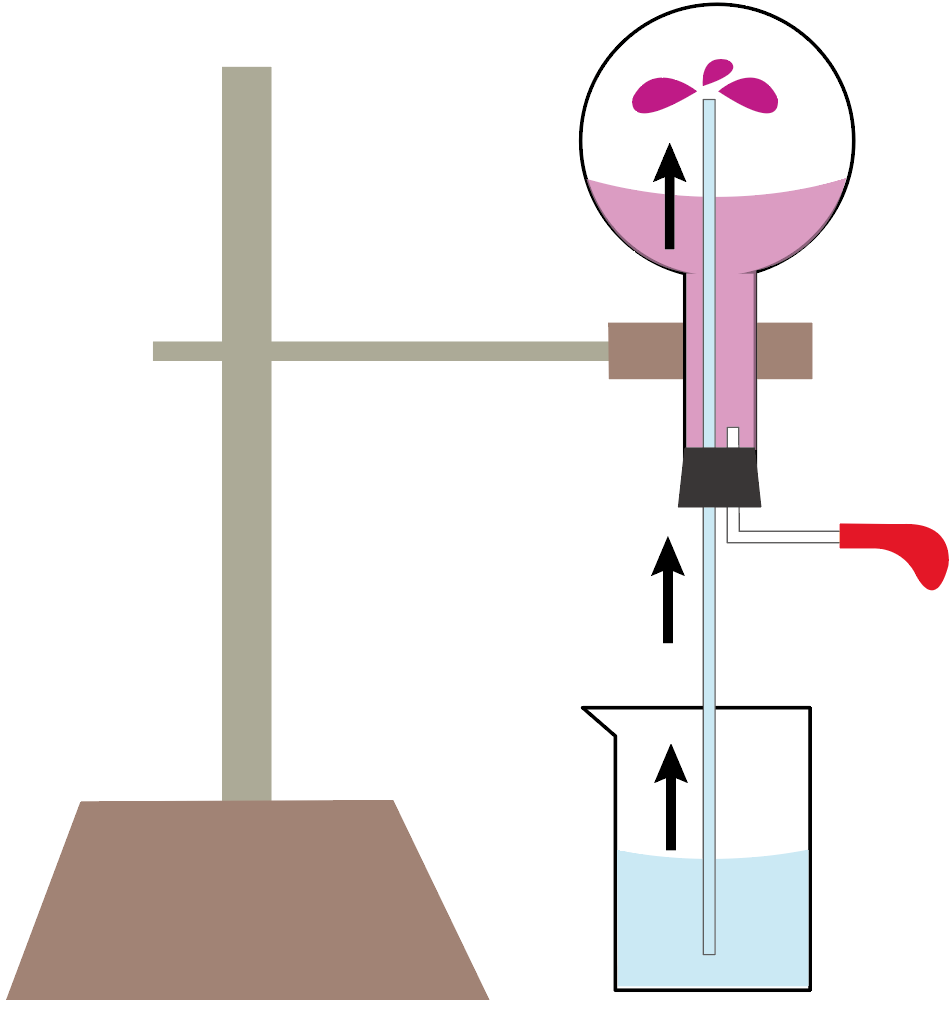
これでアンモニアの噴水実験終了。
それじゃあ、なんで、このアンモニア噴水実験が起こるんだろうね??
原理とか仕組みを知りたいよね。
順を追って、アンモニア噴水実験の仕組みを追っていこう。
まず、アンモニアの噴水実験の2ステップ目で、丸底フラスコに水をスポイトで入れたよね?
このとき、
丸底フラスコ内にあったアンモニアの気体が、
そのスポイトで入れた水に溶けちゃったんだ。
アンモニアの性質には、
水に溶けやすい
っていうやつがあったでしょ??
だから、ちょっとの水を入れただけで、気体のアンモニアは水に溶けちゃったんだよ。
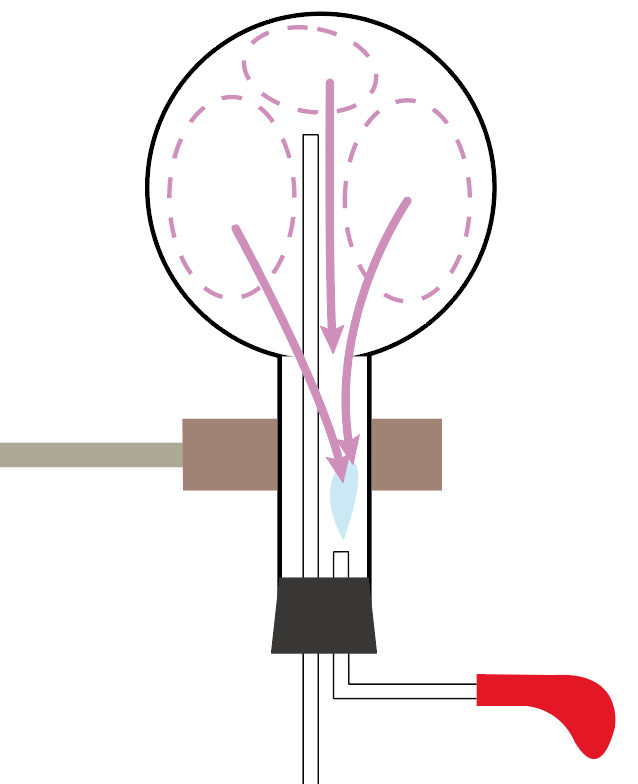
丸底フラスコの中身は、もともとあった気体のアンモニアがなくなっちゃって、真空状態。
気体が何も入ってない空っぽの状態ってわけさ。
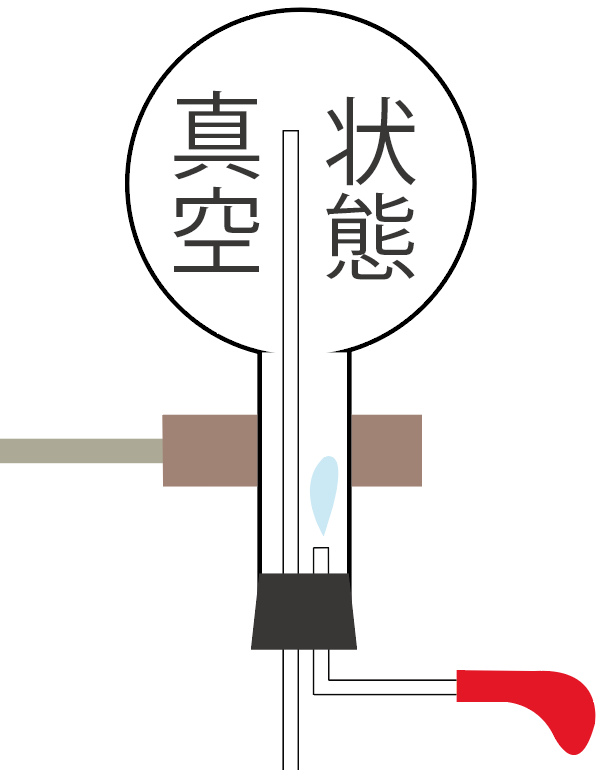
ってことは、丸底フラスコの中の圧力はすごい小さくなっちゃった。
アンモニアの気体がなくなっちゃって、何も入ってないからね。
だから、この隙間に、周りの空気がどんどん入ってこようとするんだ。
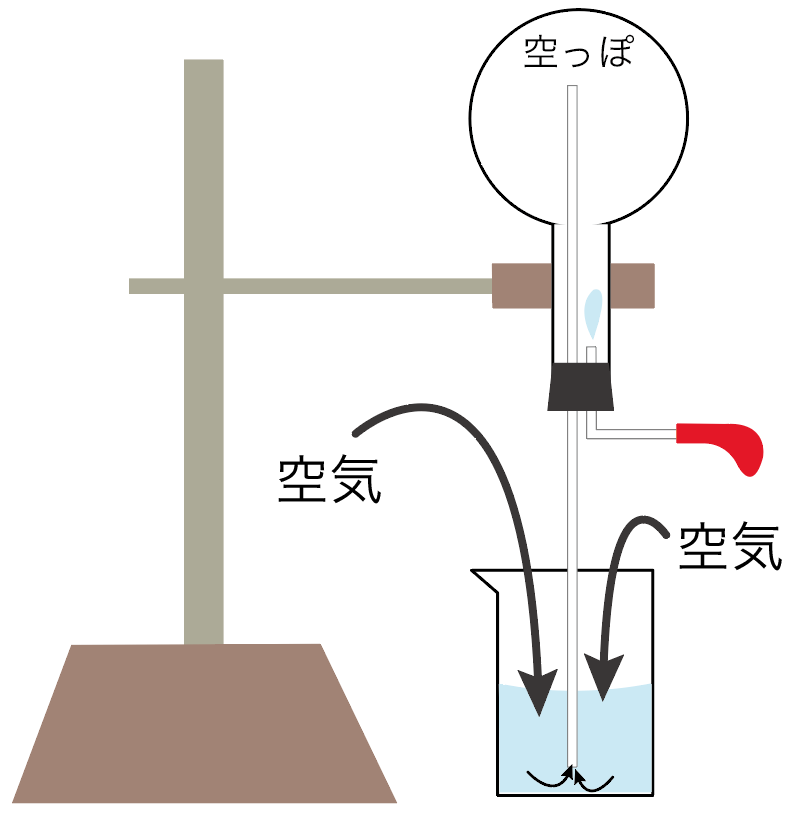
丸底フラスコの圧力が低い状況だから、ガラス管を伝って、どんどん周りの空気が入ってくる。

外から空気がガラス管経由でガンガン入ってこようとするから、フェノールフタレイン溶液が入ってる水がどんどん上に押し上げられていくのね。
吸い上げられたフェノールフタレイン溶液は、赤色に変化するよ。

なぜなら、
丸底フラスコの中には、アンモニアが溶けた水がいたからね。
スポイトでちょっと出した水は気体のアンモニアが溶けてアンモニア水になっていたんだ。
んで、アンモニア水は「アルカリ性」だから、この丸底フラスコに入るフェノールフタレインはこのアルカリ性に反応して、透明から赤色に変化するわけね。

丸底フラスコ内に十分に空気が入って、周囲の空気と同じ圧力になったら、アンモニアの噴水は終了。
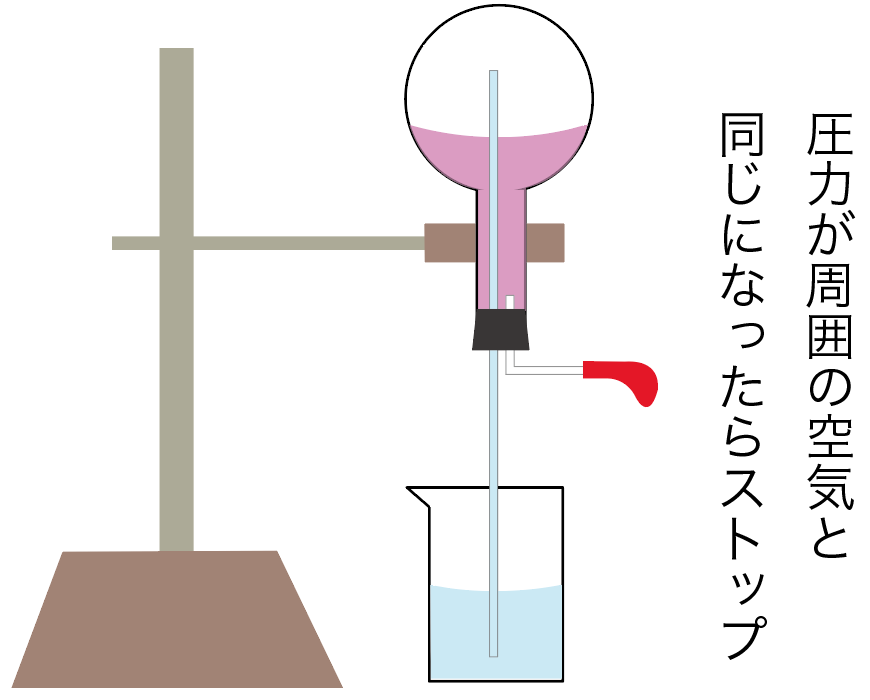
永遠にアンモニアの噴水が続くわけではないのね。
以上が、アンモニアの噴水実験のおおまかな流れだね。
最後にもう一度復習しておこう。
アンモニアの噴水実験は、
っていう実験器具たちを用意して、こんな感じでセットして行って、

アンモニアの噴水実験は、アンモニアが水に溶けやすいから、気体のアンモニアが丸底フラスコからなくなっちゃって、真空状態になるから起こる現象だったね。

テストにも出やすい実験だから、よーく復習しておこう。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。トイレに並んでみたね。
中学1年生の理科の身のまわりの物質という単元では、いろんな気体の性質をみてきたね。
などなど、これでもかってぐらい気体の種類を詳しくてみてきたから、もう気体でお腹いっぱいかもしれない。
でも、でも、あと1つだけ、詳しく勉強しておきたい気体があるんだ。
それは、
アンモニア
だ。
今日はアンモニアという気体についても、
の3つをみていこう
まずはアンモニアの作り方からね。
アンモニアは、
を混ぜて加熱すればアンモニアが発生するんだ。
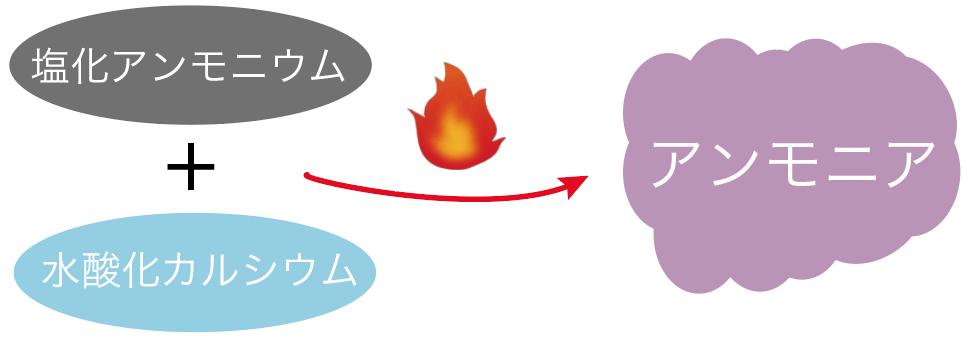
酸素や水素や二酸化炭素は物質を混ぜるだけで発生したけど、アンモニアは混ぜた後に加熱しなきゃいけない点に注意ね。
アンモニアには次の4つの性質があるよ。
アンモニアの性質の一つとして、
におい
があるってことだ。
それも、香水のようにうっとりするにおいじゃなく、
鼻を刺すようなものすごい刺激的なにおい
なんだ。

アンモニアが発生しているかどうかは、鼻をクンクンさせればよくわかるはず。
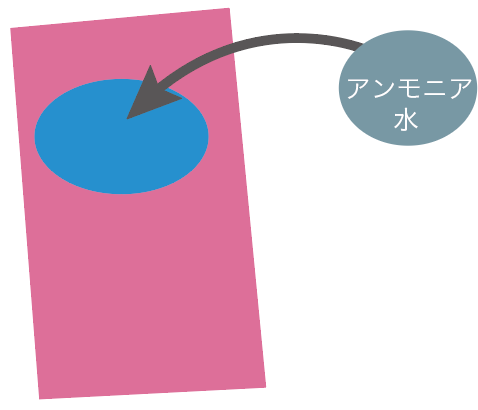
アンモニアはよく水にとける気体だ。
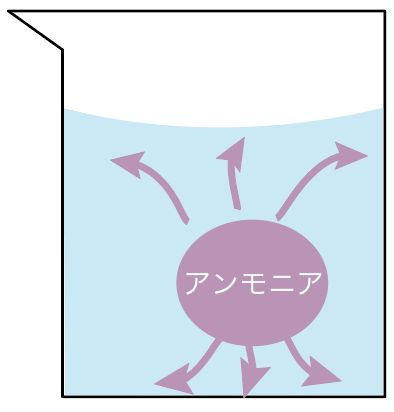
気体のアンモニアと一緒に水を入れてやると、すぐに水にとけちゃって、気体のアンモニアが姿を消すわけ。
この性質を利用すると、アンモニアの噴水の実験ができるのね。
気体のアンモニアが水に溶けると、
アルカリ性
になるよ。
だから、アンモニアが溶けた水に、リトマス紙(赤)をつけると、リトマス紙が青色に変化するんだ。
あとは、アンモニアの密度だね。
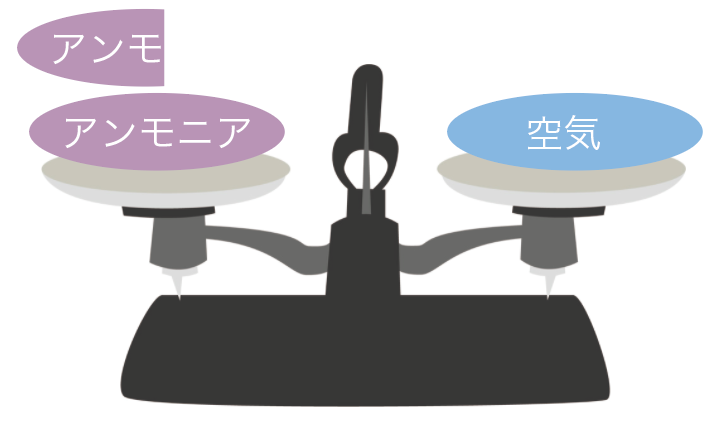
アンモニアの性質で知っておきたいこととして、
密度が空気より小さい
ってことがあるよ。
| 密度(1気圧 0℃)[kg/m³] | |
|---|---|
| アンモニア | 0.772 |
| 空気 | 1.293 |
空気と比べると、密度は0.6倍だ!
つまり、同じ体積のアンモニアと空気を同じ重さにするためには、アンモニアを1.6倍多く盛る必要があるわけね。
最後に、アンモニアの集め方もマスターしておこう。
アンモニアは「上方置換法」を使って集めていくよ。

なぜなら、アンモニアには、
っていう2つの性質があるからね。
水に溶けやすいから、水上置換法で集めると、水に溶けて気体のアンモニアがなくなっちゃう。
空気より密度が小さいから、ほおっておくと、どんどん上に昇って行っちゃうんだ。
だから、下方置換法だとぜんぜん全く、気体のアンモニアを捕まえることはできないね。
消去法として、上方置換法を使ってアンモニアを集めていくんだ。
詳しくは「気体の集め方」を読んでみてね
これでアンモニアの発生方法(作り方)・集め方・性質もマスターだね。
念のため、最後に復習しておこう。
アンモニアは、
の2つを混ぜて加熱することで発生するんだったね。

んで、アンモニアには次の4つの性質があって、
「水によく溶ける」、「空気より密度が小さい」っていう2つの性質がアンモニアにはあるから「上方置換法」で集めるよ。

最終的に、アンモニアの発生実験はこんな感じで行われるね。
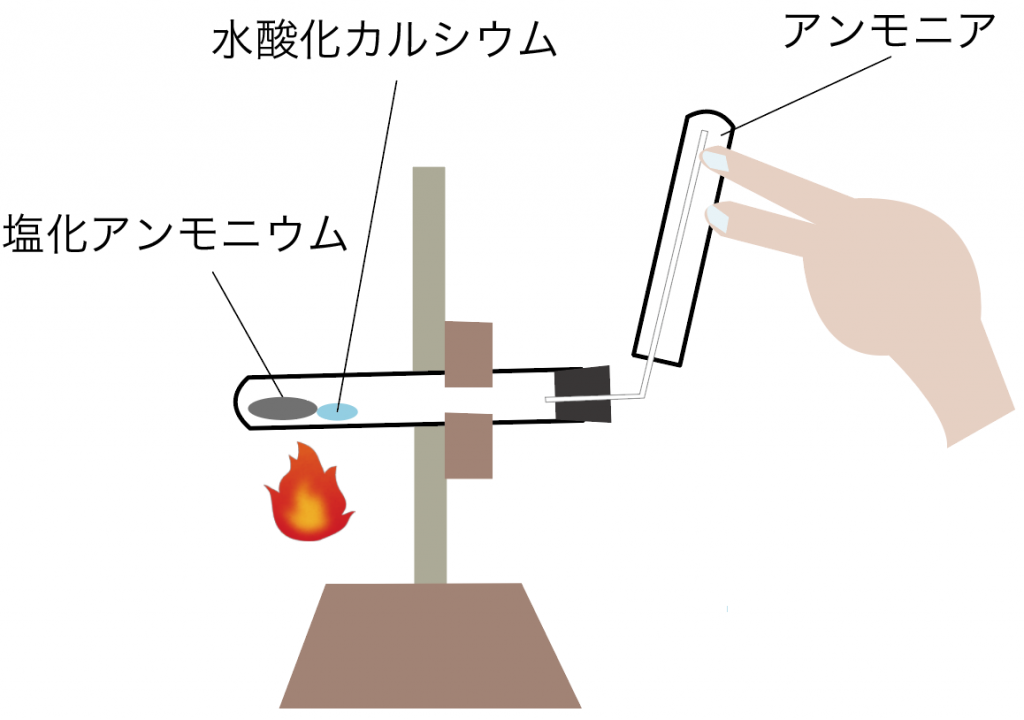
アンモニアもテストに出やすいからよーく復習しておこう。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。ジャストインタイムだね。
中1理科の身のまわりの物質では、色々な気体を発生させて、集めて、性質を調べていくよね。
ここまで、
っていう2つの気体を勉強してきたね。
今日はもう一歩頑張って、
水素
という気体について勉強していこう。
この記事で勉強していく項目は次の3つ。
まずは水素の発生方法から見ていこう。
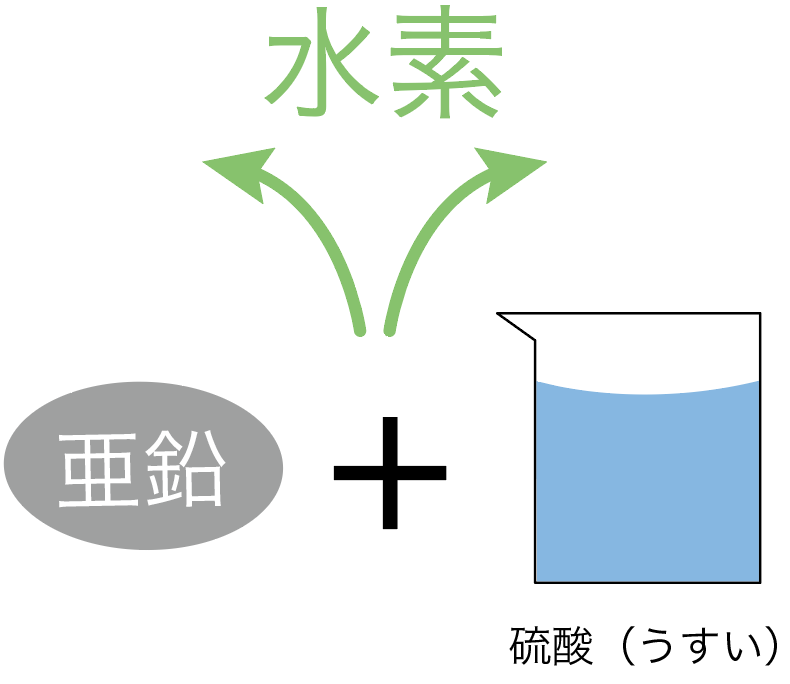
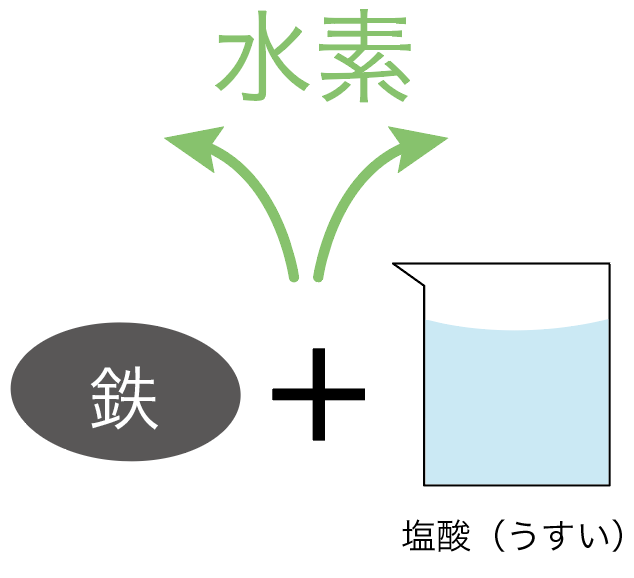
水素は、
鉄や亜鉛に、
うすい塩酸や硫酸を加えると発生するんだ。
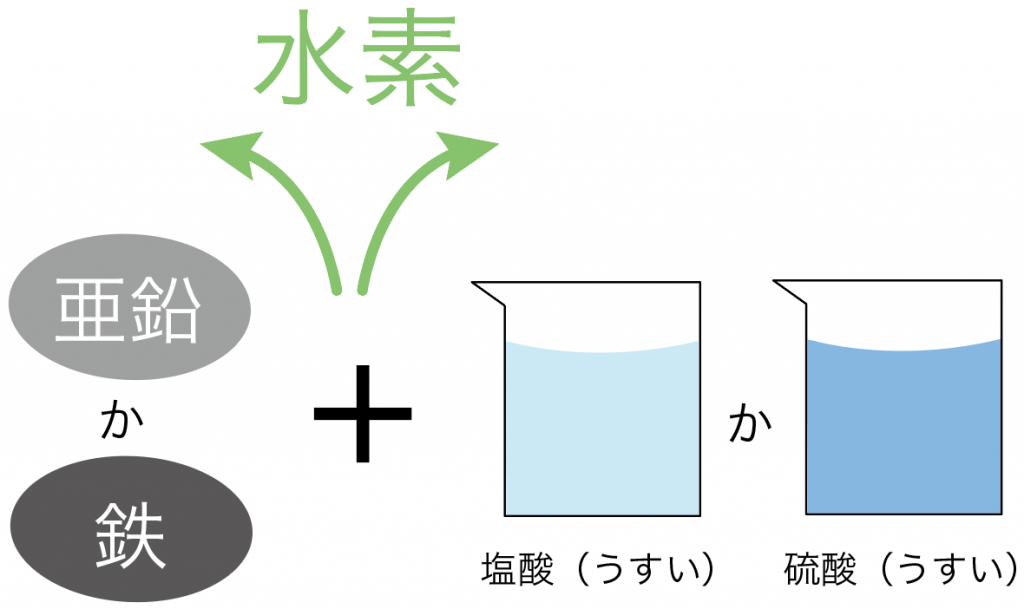
だからまあ、
の組み合わせでもいいし、
でもいいってわけ。
さて、じゃあ水素の性質にはどんなものがあるんだろうね??
中学理科で勉強する水素の性質は次の4つ。
水素の性質の中の一つとして、
水素の密度はものすごく小さい
ってことがあるんだ。
どれくらい小さいのか、空気や、これまで勉強してきた気体の密度と比較してみよう。
| 密度(1気圧 0℃)[kg/m³] | |
|---|---|
| 二酸化炭素 | 1.977 |
| 空気 | 1.293 |
| 酸素 | 1.429 |
| 水素 | 0.089 |
うわっ!
一人だけちいさ!!
空気と比較すると、空気の密度の、
0.069倍じゃないか!!
つまり、ある空気の塊と同じ質量の水素を用意したかったら、水素を空気の14倍以上集めてくる必要があるわけだね。

水素軽すぎ。
水素はすべての気体の物質の中で一番軽いんだ。おそるべしだね。
水素には、色もにおいもない。
水素がそこらへんに浮かんでいても、人間の目には映らないし、鼻も存在をキャッチでいないね。
水素という気体は、水に溶けにくい。
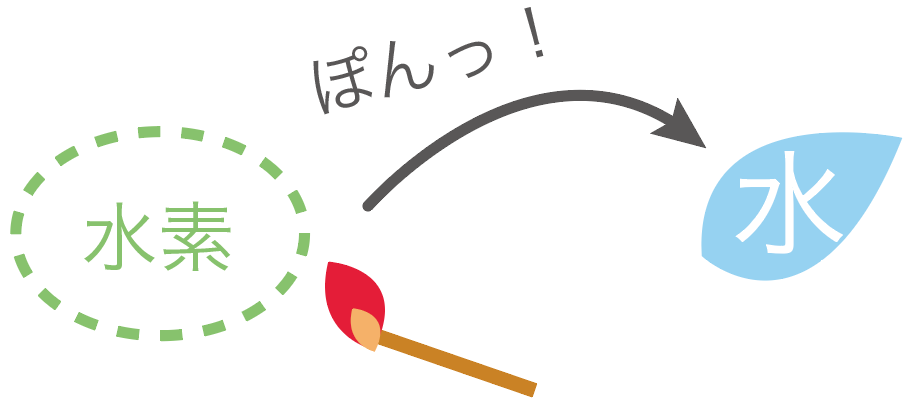
気体の水素は、燃えると、水になるんだ。
気体の水素に、火をつけたマッチ棒を近づけていくと、
ぽん!
って音がして、水ができちゃうね。
さて、最後に水素の集め方を見ていこう。
水素は「水上置換法」で集めていくよ。
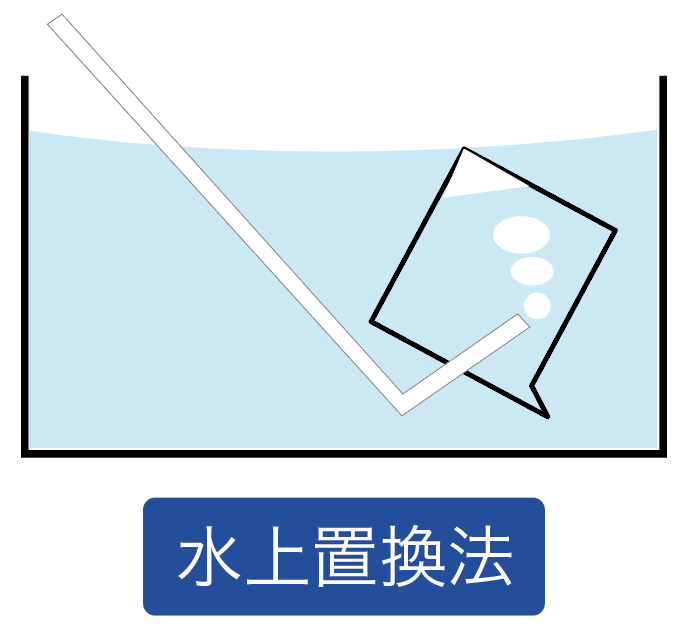
水と気体を置き換えて、気体を集めていく方法だったね。
なぜ、水素を水上置換法で集めるのかというと、水素の性質に、
水に溶けにくい
というものがあったからね。
水素は水に溶けにくいから、気体が水に溶けてとり逃がすといったことが少なくなるわけ。
>>詳しくは「気体の集め方」を復習をしてみて
と、以上が水素の発生方法(作り方)・集め方・性質だよ。
最後にもう一回、復習しておこう。
水素は、
を混ぜると発生して、

次の4つの性質を持っていて、
水素は水に溶けにくいから、
水上置換法
で集めていくんだ。

水素を発生させる実験はだいたいこんな感じになるね。
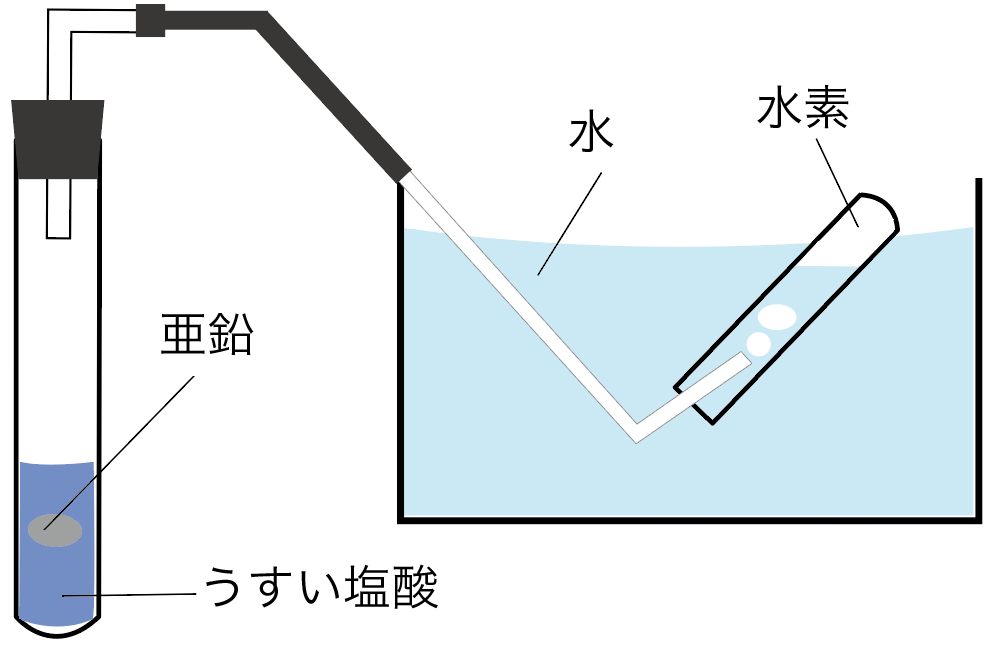
テストに出やすいからよーく復習しておこう。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。バリ島、呼んでるね。
中1理科の「身のまわりの物質」では、色々な気体を発生させて、集めて、その性質を調べていくよね?
ぶっちゃけ、いろいろな気体のことを勉強しすぎてわけわからなくなっちゃうぜ。
今日は、そんな中1理科でごちゃごちゃと勉強してきた気体のうち、
二酸化炭素
について詳しくみていこう。
まずは、二酸化炭素の発生方法から見ていこう。
ドライアイスを溶かしたり、炭酸バブを風呂にぶち込めば二酸化炭素は発生する。
しかし、今日は中学の理科で勉強する王道中の王道の作り方を紹介していくよ。
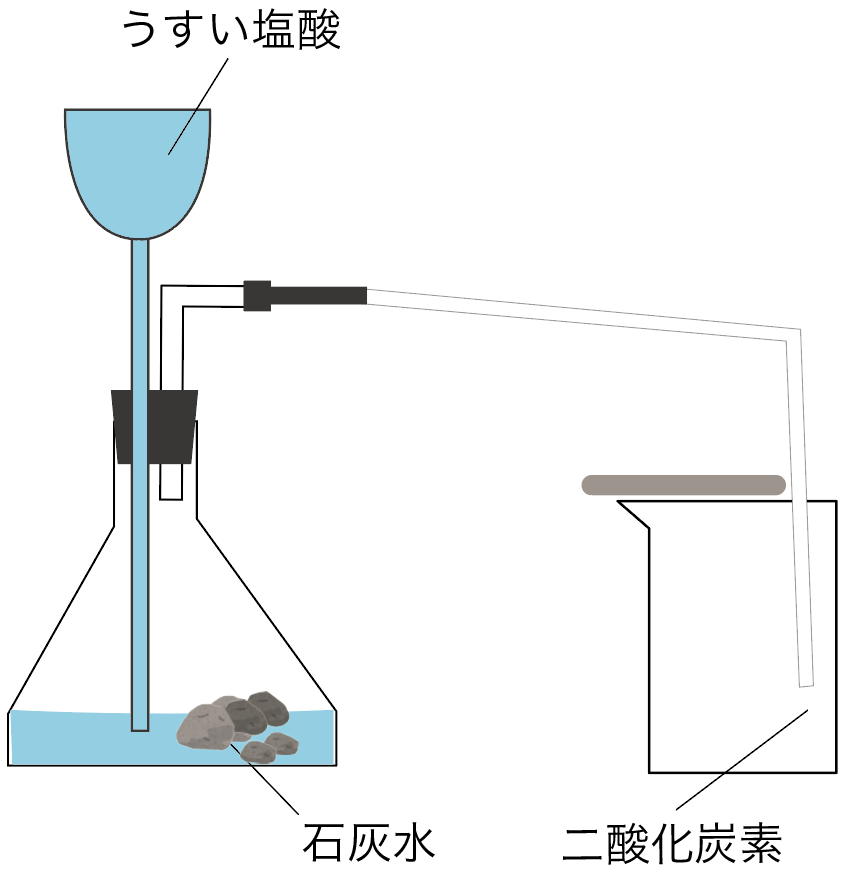
ズバリ、二酸化炭素の作り方は、
「石灰石」に「うすい塩酸」を加えればいいんだ。
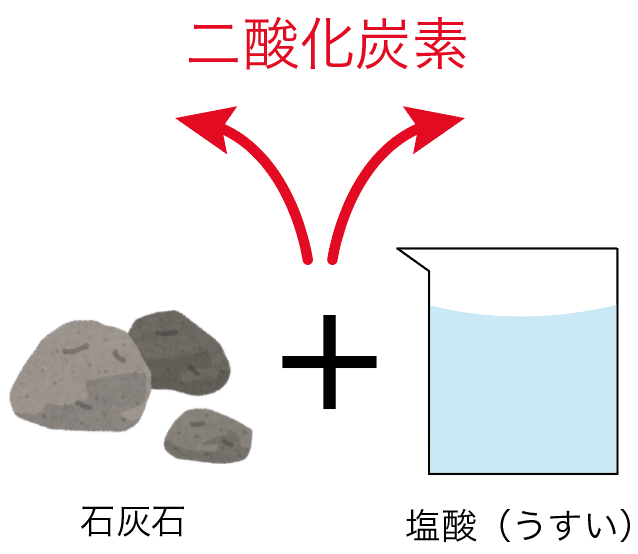
石灰石とは簡単にいうと、「大昔にサンゴが積み重なってできた石」のことだ。
Amazonでも普通に購入できるね。
主に、ガーデニングの時に使う石(防犯・防草)として使われているんだ。
じゃあ、
を混ぜてできる二酸化炭素にはどういう性質があるんだろうね??
中学理科で勉強する二酸化炭素の性質は、次の4つ。
一つ目の二酸化炭素の性質は、
空気より密度が大きい
ということだ。
二酸化炭素と空気の密度を比較してみると、
| 密度(1気圧 0℃)[kg/m³] | |
|---|---|
| 二酸化炭素 | 1.977 |
| 空気 | 1.293 |
ってなってるね。
じつに、二酸化炭素の密度は空気の密度の、
1.53倍!!
空気と二酸化炭素を同じ体積だけ捕まえたとしたら、二酸化炭素の方が1.5倍ぐらい重いってことだ。

2つ目の二酸化炭素の性質は、
であるということ。
人間の目では色も形も見えないし、鼻を近づけても香りがしないというわけだ。
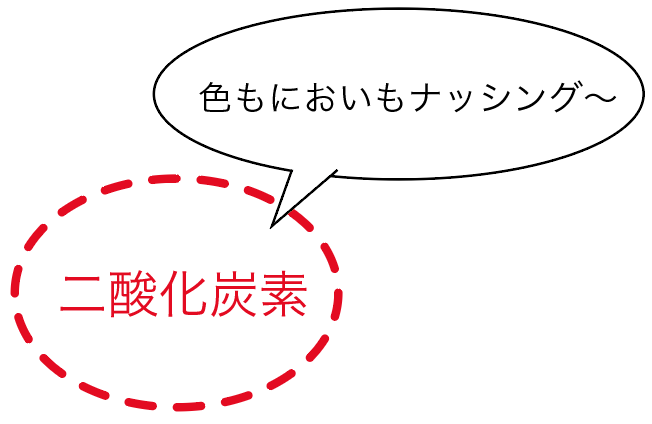
だから、そこら中に二酸化炭素がばらまかれたとしても、見た目や臭いからは察知できないってこと。
二酸化炭素の3つ目の性質は、
石灰水を白く濁らせるというやつだ。
もし、二酸化炭素がたっぷりと入った試験管に、石灰水が入っていたとしよう。
この時、石灰水と二酸化炭素が十分混ざるように、試験管をシェイクしてやると、白く濁るはず。
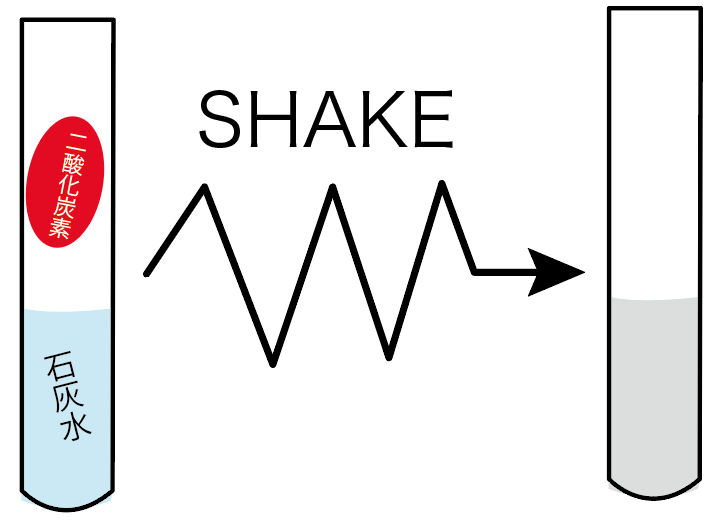
この二酸化炭素の性質から、石灰水は「二酸化炭素が発生したかどうかを調べる液体」として使われることが多いね。
二酸化炭素は「水に溶けにくい」っていう性質があるよ。
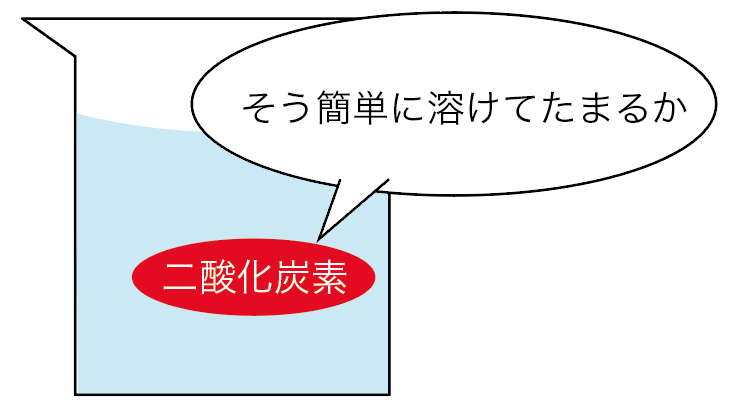
じゃあ、二酸化炭素はどうやって集めるんだろうね??
二酸化炭素は次の2つの集め方が使えるよ。
まずは下方置換法だ。
空気と発生する気体を置き換えることで集める方法で、しかも、空気を集める容器の底を下方向に向ける集め方だ。
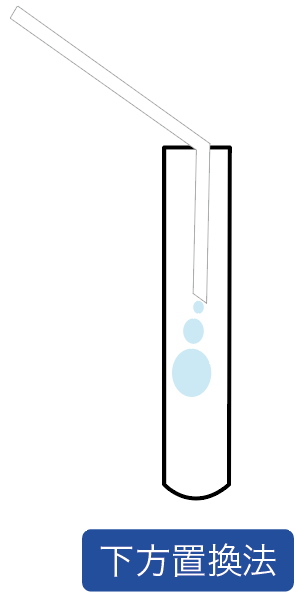
なぜ、二酸化炭素の集め方で「下方置換法」が使えるのかというと、
二酸化炭素の性質の2つ目の「二酸化炭素の密度は空気の密度より大きい」っていう性質があるからなんだ。
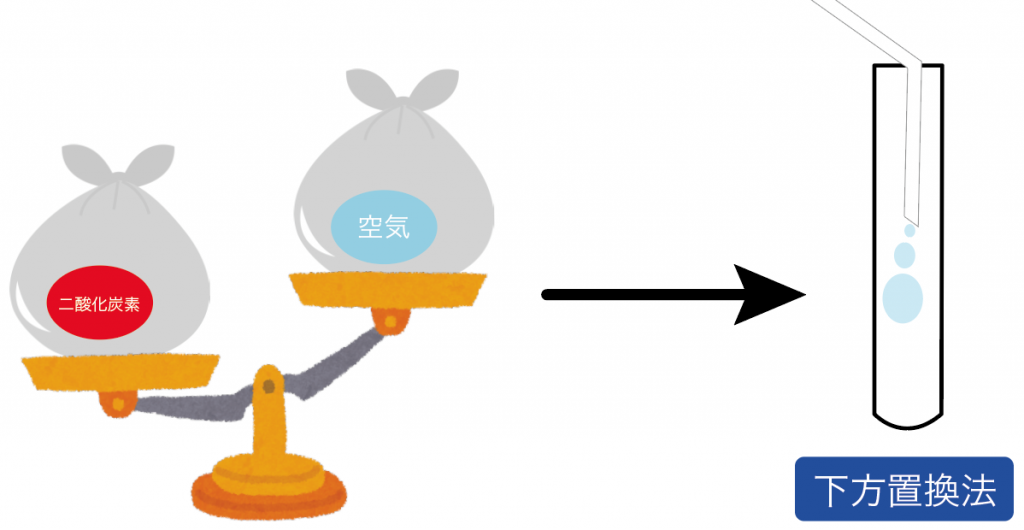
これにより、二酸化炭素が出てきても、空気より密度が大きいから下に沈んでいくはずなんだ。
下に沈んでいくから、下に容器の底をセッティングしておけば、取り残しなしで二酸化炭素を確保できるはず。
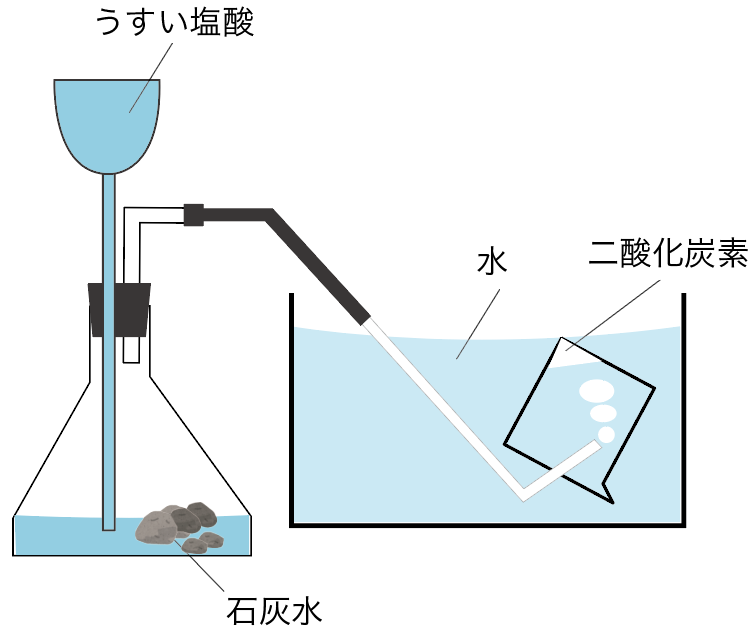
二酸化炭素は「水上置換法」でも集めることができるね。

水上置換法とは、水と発生する気体を置き換えて集める方法だったね。
なぜ、水上置換法でも二酸化炭素を集められるのかというと、二酸化炭素には
水に溶けにくい
っていう性質があるからさ。
これは酸素と同じ性質。つまり、酸素も二酸化炭素も水上置換法で集めることができるわけさ。
以上が、二酸化炭素の発生方法(作り方)・集め方・性質だ。
最後に軽く復習しておこう。
二酸化炭素は、
を混ぜると発生して、

っていう4つの性質があって、この1と4の性質から、
っていう2つの集め方で二酸化炭素を集めることができるんだ。
二酸化炭素の発生の実験は下方置換法はこんな感じ、
水上置換法はこんな感じで行われるね。
二酸化炭素はテストに出やすいからよーく復習しておこう。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。プロテイン、摂取したね。
中学1年生の理科では、気体の性質を勉強していくよね。
酸素や二酸化炭素、水素など身近な気体たちを発生させたり、そいつらの性質を調べたりしていく単元だ。
今日は、中でも特にテストに出やすい、
酸素
にフォーカスしてみよう。
この記事では、
をわかりやすく解説していくよ。
まずは、酸素っていう気体の発生方法・作り方だ。
酸素は次の2つの物質を混ぜると発生するよ。
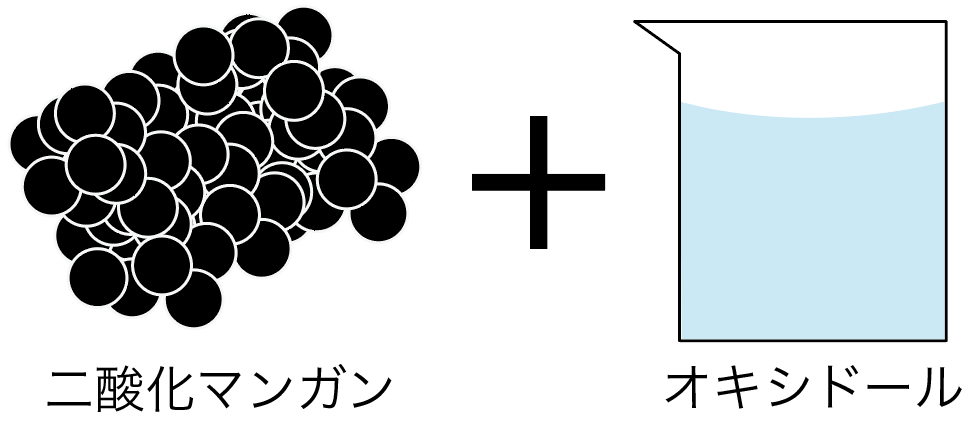
オキシドールが分解されて酸素が発生するようになっているんだ。
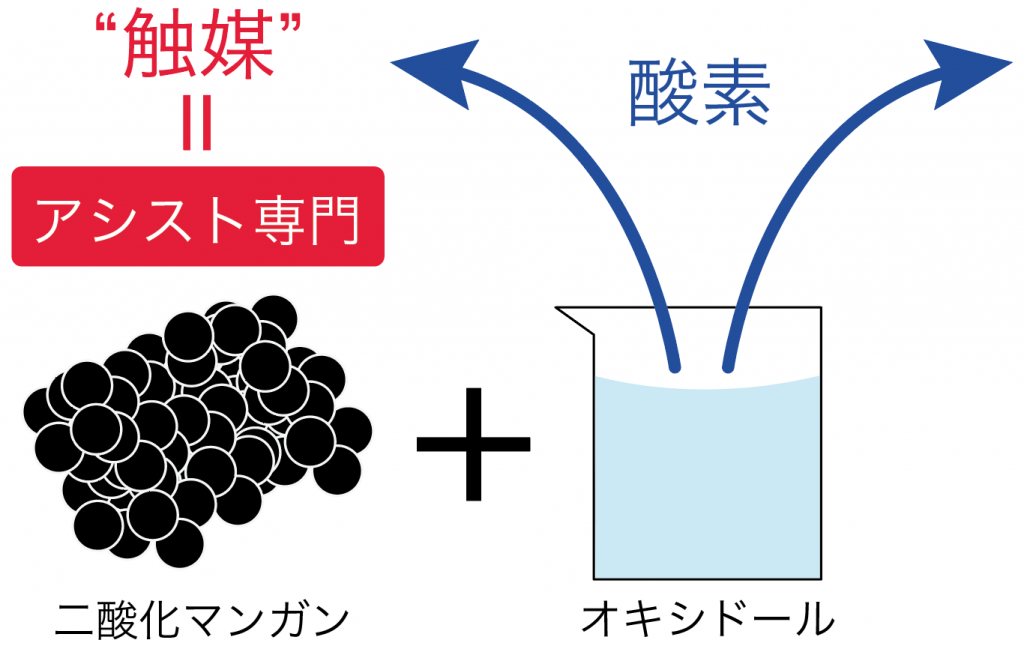
二酸化マンガンはただただ、オキシドールが酸素になるのをアシストしているだけ。
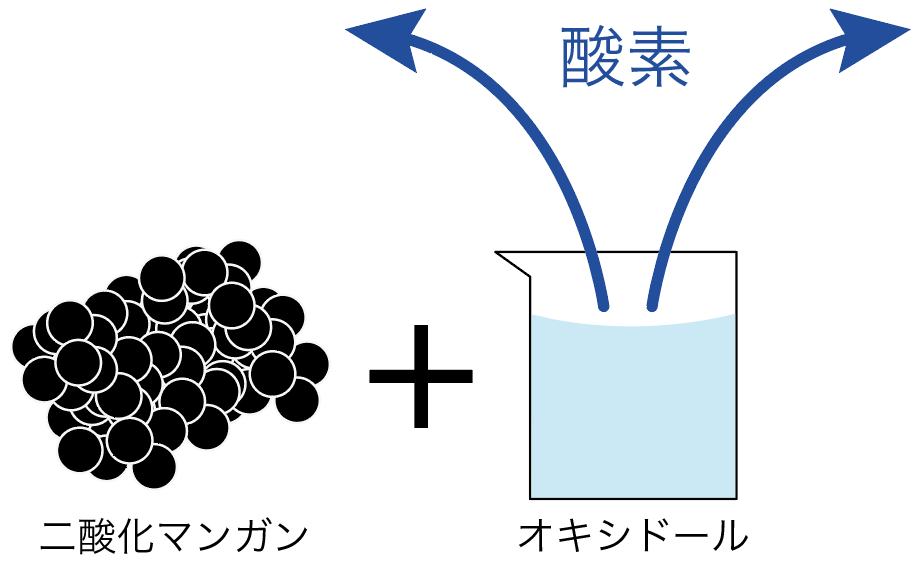
だから、二酸化マンガンは酸素が発生しても変化しないで残るわけね。
この二酸化マンガンみたいに、化学変化のときに自分自身が変化せずに、他の物質の反応の速さを変化させる物質のことを「触媒」って呼んでいるよ。
さて、
を混ぜてようやく酸素を発生させることができたね。
じゃあ、酸素にはどういう性質があるんだろう??
中学理科では次の3つの性質を押さえて置けば問題ないぜ。
まず、水に溶けにくい。
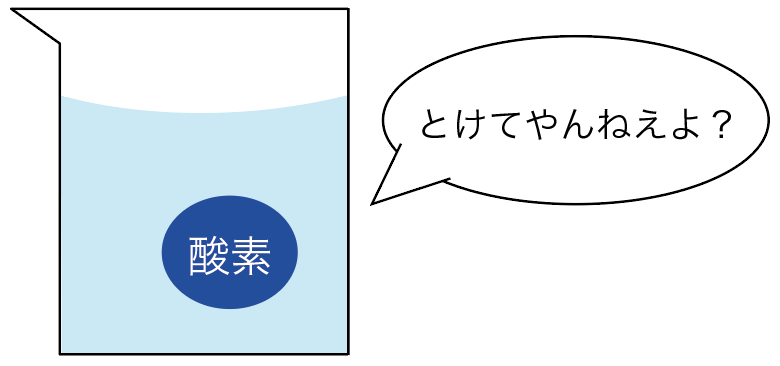
色もついてないし、においもなし。

ものが燃やす働きもあるよ。

酸素自体は燃えないけどね。
最後に、酸素の集め方。
酸素の集め方は、3つの気体の集め方のうち、
水上置換法
を使って集めていくんだ。

水で満たしたビーカーの中に、酸素の出口をぶち込んで、中に入ってる水と出てくる酸素を置き換える集め方だったね。
なぜ、この水上置換で集めるんだろうね??
その理由は酸素の性質に、
水に溶けにくい
という性質があるからなんだ。
水上置換法は、一番確実に気体を集められて、取りこぼしの少なく、発生する気体の様子がみれるから、一番無難。
だから、水に溶けにくいっていう性質がある気体なら、一番「水上置換法」がおすすめってわけだ。
>>詳しくは「気体の集め方」を参照してみてね
以上が、酸素の発生方法・集め方・性質だったね。
最後に復習しておこう。
酸素は、
を混ぜると発生して、

酸素には次の3つの性質がある。
んで、酸素には「水に溶けにくい」っていう性質があるから、
気体の集め方は「水上置換」を使うんだ。

酸素を発生する実験用具の様子は、だいたいこんな感じになるね。
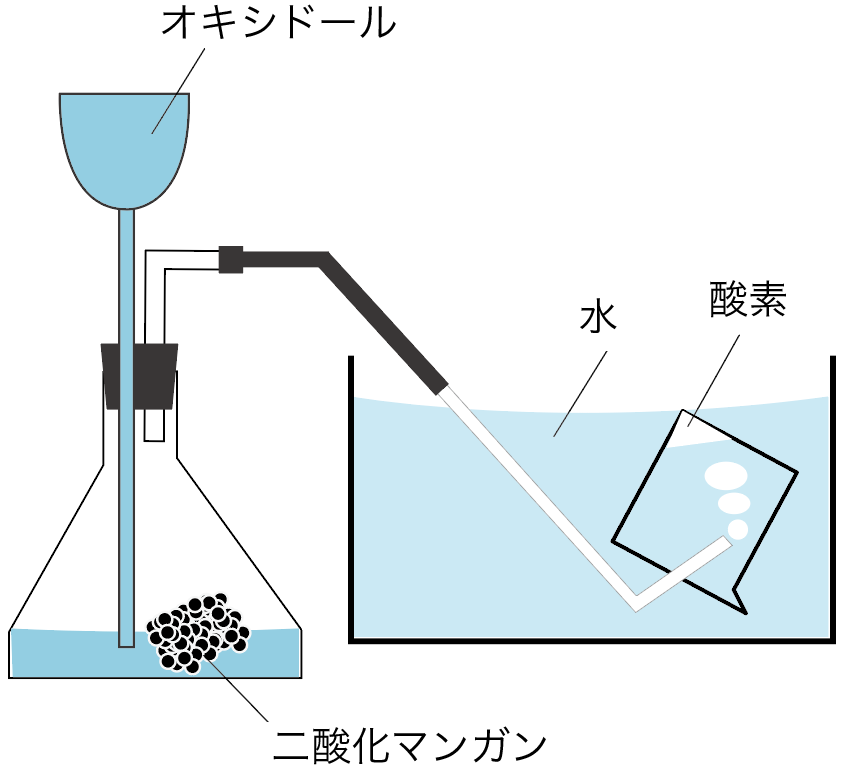
気体の性質・集め方でも酸素は出やすい気体だから、テスト前によーく復習しておこう。
そんじゃねー
Ken
こんにちは!この記事を書いてるKenだよ。全身、緑で決めたね。
中学1年生の理科では、
プラスチック
を勉強していくよ。プラスチックはまたの名を「合成樹脂」と言い、
「石油」を元にして人工的に作られた有機物のこと
だ。
石油の成分の中でも「ナフタ」という物質を原料にすることが多いね。
プラスチックの種類はたくさんあって、それぞれのプラスチックが種類ごとにそれぞれの性質を持ち味にして、生活に溶け込んでいるんだ。
今日は、そんなプラスチックの性質をさらっと紹介しよう。
プラスチックには次の5つの性質があるよ。
プラスチックは加工しやすい。
お皿とか、消しゴムとか、サランラップとかいろんな形のものプラスチックで作れちゃうわけ。
プラスチックは色だってつけやすい。
緑でも赤でも青でもなんでもありだ。
しかも、軽い。
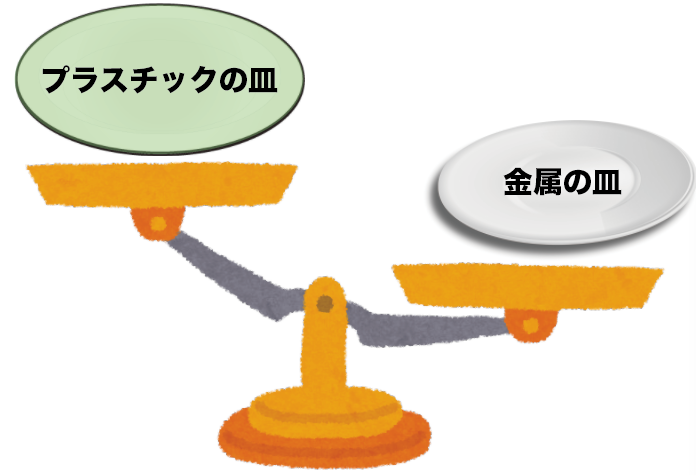
しかもしかも、さびない。
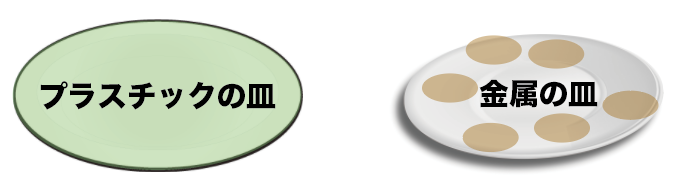
しかもしかもしかも、腐りにくい。

ただし、電気は通さない。
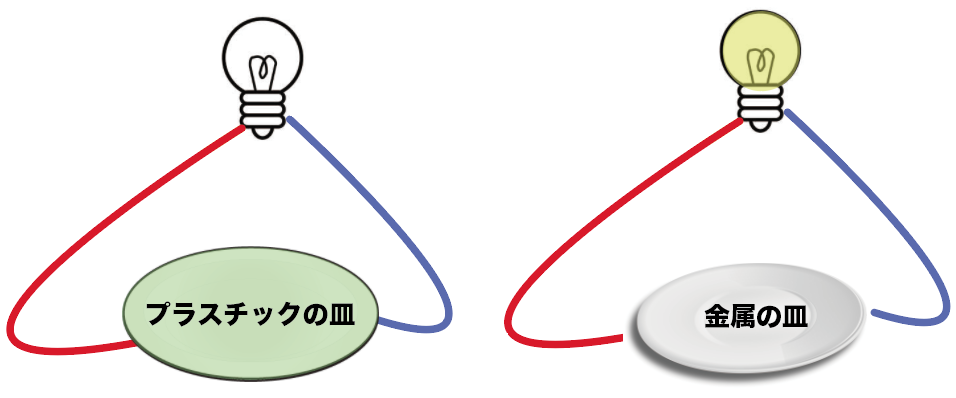
だがしかし、衝撃には強い。
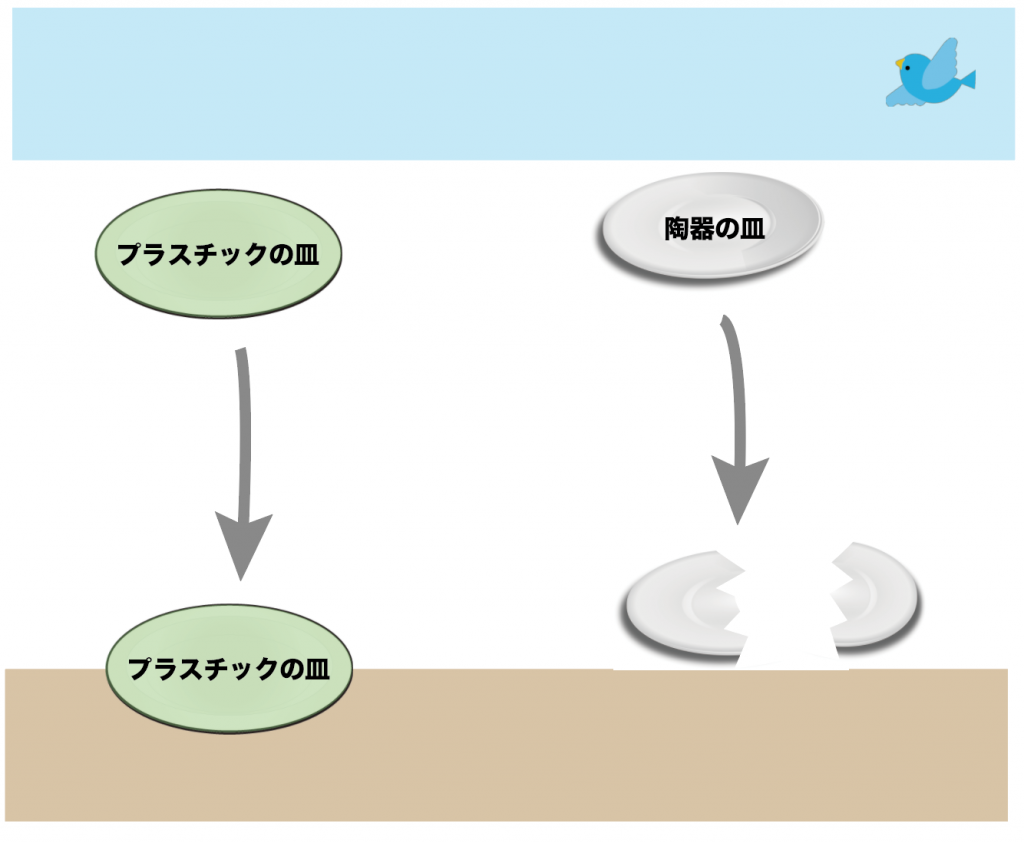
落としても割れないね。
と、以上がプラスチックの性質だよ。
ただ、プラスチックの性質を覚えるのはつまらないし、正直、覚えにくい。
身の回りのプラスチック製品を想像して、そいつがどんな性質を持っているかを考えてみると面白いね。
プラスチックの性質をマスターしたら次はプラスチックの種類を勉強してみよう。
そんじゃねー
Ken
こんにちは!この記事を書いてるKenだよ。プルタブ、集めたいね。
中1理科では、プラスチックの種類を勉強していくよ。
プラスチックといえば、身近のいろんなところで使われているね。
携帯電話とか、レジ袋とか、掃除のバケツとか、消しゴムとか、シャープぺんとか、もうほんと色々。
今日はそんな身近なプラスチックの種類のうち、中学理科のテストに出やすいものをわかりやすくまとめてみたよ。
一旦、全部のプラスチックの種類を表にまとめると、こんな感じになる↓↓
スマホは横にしてみてね。
| ポリエチレン | ポリエチレンテレフタラート | ポリ塩化ビニル | ポリスチレン | ポリプロピレン | |
|---|---|---|---|---|---|
| 略称 | PE | PET | PVC | PS | PP |
| 用途 | レジ袋、ラップ、バケツ | ペットボトル、卵の容器、写真フィルム | 消しゴム、ホース、水道管 | CDケース、食品容器、トレイ | ペットボトルのふた、ストロー、医療機器 |
| 性質 | 油や薬品に強い。安価で加工しやすい | 透明で圧力に強い。薬品に強い | 薬品に強い。光沢、艶がある。軟らかいものと硬いものあり | 断熱保温性。透明で固い、着色が簡単 | 熱に強く、強度に優れる |
| 密度 [g/cm³] | 0.92~0.97 | 1.38~1.40 | 1.2~1.6 | 1.05~1.07 | 0.90~0.91 |
| 水に浮く? | YES | NO | NO | NO | YES |
| 耐熱温度 | 70~110℃ | 85~200℃ | 60~80℃ | 70~90℃ | 100~140℃ |
| 燃えやすい? | YES | YES | NO | YES | NO |
※参考サイト「こんにちは!プラスチック」
それじゃあ、ひとつひとつのプラスチックの種類を詳しく見ていこうか。

| 名前 | ポリエチレン(polyethylene) |
|---|---|
| 略称 | PE |
| 用途 | レジ袋、ラップ、バケツなど |
| 性質 | 油や薬品に強い。安価で加工しやすい |
| 密度 [g/cm³] | 0.92~0.97 |
| 水に浮く? | YES |
| 耐熱温度 | 70~110℃ |
| 燃えやすい? | YES |
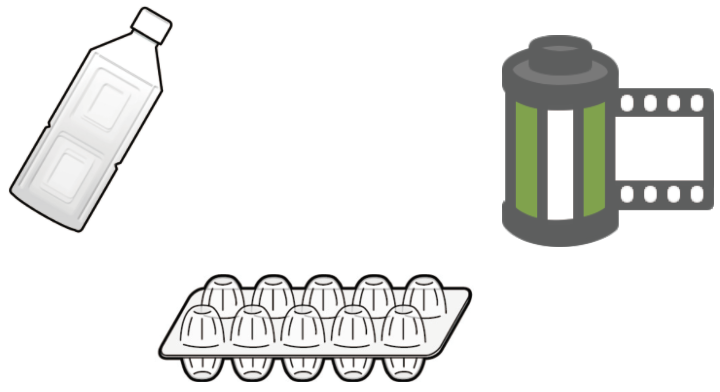
レジ袋やラップなどに使われているプラスチックポリエチレン。
やすいお値段で加工しやすいから、大量に生産しやすいのが特徴。
水よりも密度が小さいので、水に沈めたら浮くプラスチックの種類だね。
| 名前 | ポリエチレンテレフタラート(polyethylene terephthalate) |
|---|---|
| 略称 | PET |
| 用途 | ペットボトル、卵の容器、写真フィルムなど |
| 性質 | 透明で圧力に強い。薬品に強い。 |
| 密度 [g/cm³] | 1.38~1.40 |
| 水に浮く? | NO |
| 耐熱温度 | 85~200℃ |
| 燃えやすい? | YES |
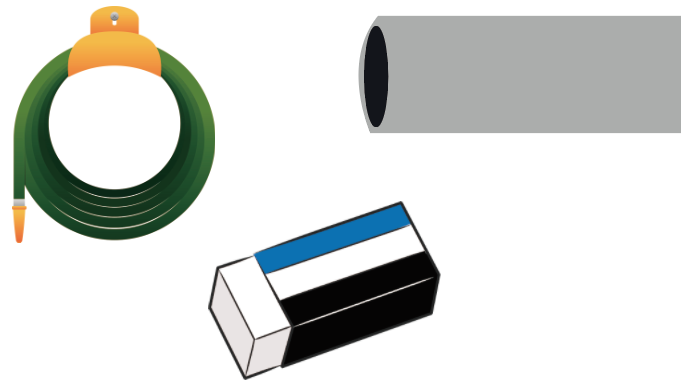
透明で薄く加工しやすいプラスチックの種類。
密度が1[g/cm³]以上なので水に入れると沈む。
| 名前 | ポリ塩化ビニル(polyvinyl chloride) |
|---|---|
| 略称 | PVC |
| 用途 | 消しゴム、ホース、水道管など |
| 性質 | 薬品に強い。光沢、艶がある。軟らかいものと硬いものあり |
| 密度 [g/cm³] | 1.2~1.6 |
| 水に浮く? | NO |
| 耐熱温度 | 60~80℃ |
| 燃えやすい? | NO |
密度が水よりも大きいため、水に沈む。
燃えにくく、薬品に強いのが特徴。

| 名前 | ポリスチレン(polystyrene) |
|---|---|
| 略称 | PS |
| 用途 | CDケース、食品容器、トレイなど |
| 性質 | 断熱保温性。透明で固い、着色が簡単 |
| 密度 [g/cm³] | 1.05~1.07 |
| 水に浮く? | NO |
| 耐熱温度 | 70~90℃ |
| 燃えやすい? | YES |
ポリスチレンと発泡ポリスチレンの2種類が存在。
発泡ポリスチレンは断熱保温性に優れており、牛丼やカップラーメンなどの食品容器として利用されることが多い。
一方、ポリスチレンは透明で着色しやすく、固いからCDケースなどに使われるよ。
密度が1[g/cm³]以上だから水に沈むね。
| 名前 | ポリプロピレン(polypropylene) |
|---|---|
| 略称 | PP |
| 用途 | ペットボトルのふた、ストロー、医療機器など |
| 性質 | 熱に強く、強度に優れる。 |
| 密度 [g/cm³] | 0.90~0.91 |
| 水に浮く? | YES |
| 耐熱温度 | 100~140℃ |
| 燃えやすい? | NO |
プラスチックの種類の中でも密度が最も小さいのが特徴。
比較的耐熱性に優れてるから熱にも強い。
以上が、中学理科で勉強するプラスチックの種類だね。
全部で5つだ。もう一回、表で復習しておこう。
| ポリエチレン | ポリエチレンテレフタラート | ポリ塩化ビニル | ポリスチレン | ポリプロピレン | |
|---|---|---|---|---|---|
| 略称 | PE | PET | PVC | PS | PP |
| 用途 | レジ袋、ラップ、バケツ | ペットボトル、卵の容器、写真フィルム | 消しゴム、ホース、水道管 | CDケース、食品容器、トレイ | ペットボトルのふた、ストロー、医療機器 |
| 性質 | 油や薬品に強い。安価で加工しやすい | 透明で圧力に強い。薬品に強い | 薬品に強い。光沢、艶がある。軟らかいものと硬いものあり | 断熱保温性。透明で固い、着色が簡単 | 熱に強く、強度に優れる |
| 密度 [g/cm³] | 0.92~0.97 | 1.38~1.40 | 1.2~1.6 | 1.05~1.07 | 0.90~0.91 |
| 水に浮く? | YES | NO | NO | NO | YES |
| 耐熱温度 | 70~110℃ | 85~200℃ | 60~80℃ | 70~90℃ | 100~140℃ |
| 燃えやすい? | YES | YES | NO | YES | NO |
覚え方はね、ぶっちゃけない。
プラスチックの略称は、英語の名前の頭文字からとってるから、英語の名前をみながら覚えるのが有効だ。
あとは、プラスチックの用途のイラストと名前をみて覚えて、右脳にプラスチックの種類と用途を刻み込んでいこう!
そんじゃねー
Ken
こんにちは!この記事を書いてるKenだよ。100%勇気だね。
中1理科で「シダ植物とコケ植物」を勉強していくよね?
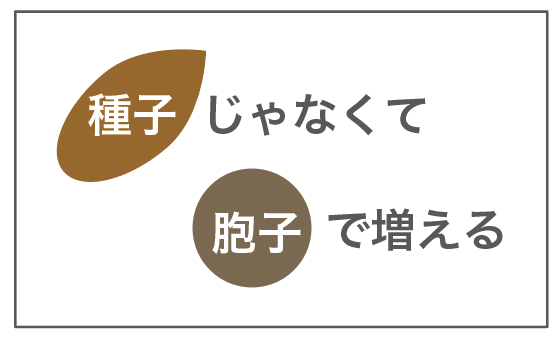
シダ植物・コケ植物は、種子植物と違って、
「種子」ではなく「胞子」で子孫を残す
って習ったね。
でもさ、そもそも、
「種子」と「胞子」って何が違うんだろう
って思わない?

両方とも見た目は種っぽいし、漢字だって1文字しか違わない。
子孫を残すっていう目的は同じだし、一体全体、何が種子と胞子の違いなんだよ!?
種子と胞子の違いはズバリ、
受精するタイミング
が違うんだ。
もっと詳しくいうと、
ばらまかれる「前」に受精するのか、ばらまかれた「後」に受精するか??
の違いがあるんだよ。
種子と胞子の違いをそれぞれ見ていこうか。
まずは種子からね。
種子は、ばらまかれる「前」に受精するんだ。

雄花が放った花粉が雌花について受精すると、「胚珠」っていう奴が「種子」に進化するんだったね??
そして、受精が起こった後に、種子がばらまかれて子孫が増える仕組みになっているんだ。
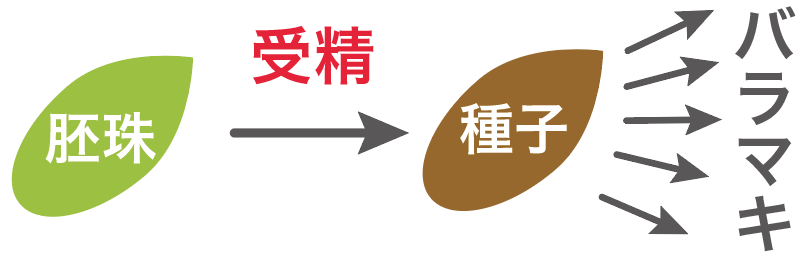
これが種子。
続いては胞子。
胞子は、ばらまかれた「後」に受精するようになってるんだ。

胞子はばらまかれた後、配偶体と呼ばれるものに成長して、その上で受精が起きるようになっているんだ。
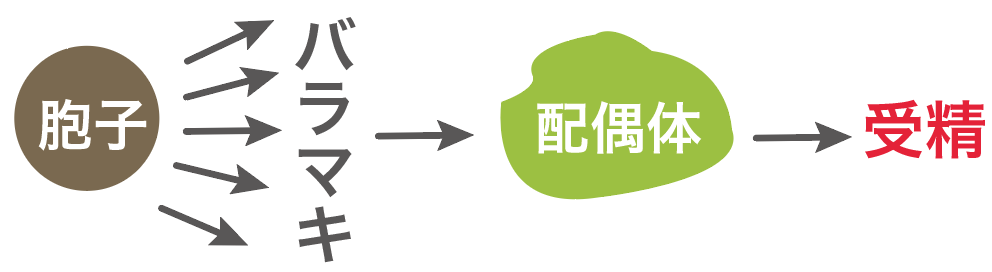
シダ植物のイヌワラビだったら、胞子が発芽して前葉体というものになり、そこで受精が起きるんだったね。
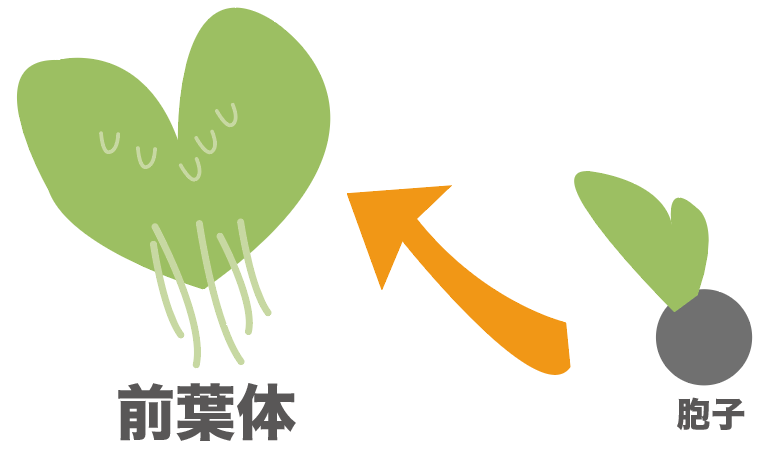
だから、胞子の時点では受精は起きてない。
受精する前にばらまかれてるっていうのが胞子の特徴だ。
以上が、種子と胞子の違いだよ。
違いはズバリ、
受精のタイミングだったね。
ばらまかれる前に受精するのが「種子」、ばらまきの後に受精するのが「胞子」と覚えておこう。

そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。カーテンは閉めないね。
中1理科では、
の2つの言葉を勉強していくよね??
有機物と無機物は1文字しか違わないし、あやうく「有理数と無理数」と混同しそうになるぐらいややこいぜ。
しかも、有機物と無機物に限ってテストに出やすいから困っちゃうよね。
今日はそんな「有機物と無機物の違い」をわかりやすくまとめてみたよ。
よかったら参考にしてみて。
早速、有機物と無機物の違いを解説していくよ。
有機物と無機物にはズバリ、
炭素を含む物質かどうか?
っていう違いがあるよ。
炭素を含む物質を「有機物」、炭素を含まない有機物ではない物質を「無機物」ってよんでるんだ。

大雑把にいうとね。
もうちょっと詳しくみていこう。
有機物とはさっきもちらっと触れたように、
炭素を含む物質
のことだね。
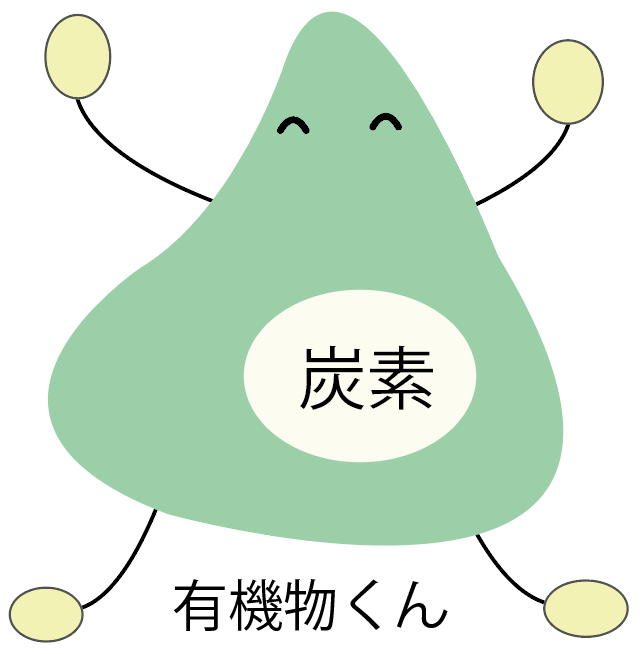
たとえば、砂糖とかジャガイモのデンプンとかが有機物だ。
こいつらはみんな炭素を含んだ物質なんだ。
だがしかし、大人の都合もあってか、
二酸化炭素、炭素、一酸化炭素は炭素を含んでるんだけど、有機物には分類されない
っていうことに注意してね。
無機物とは、
有機物では無い物質のことだ。
炭素や二酸化炭素などの有機物の仲間に入れなかった一部の例外の物質をのぞくと、
炭素を含まない物質とも言えるね。
無機物の具体例としては、食塩とか金属かな。
だがしかし、有機物と無機物の違いは外見上からはよくわからないよね??
炭素を含んでるかどうかなんて、見た目からだとエスパー能力がないと判断できない。
じゃあ一体、どうやって有機物と無機物を見分けるのかというと、
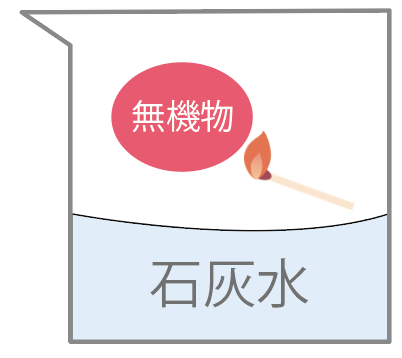
加熱して反応を見る
っていう方法が一般的だ。

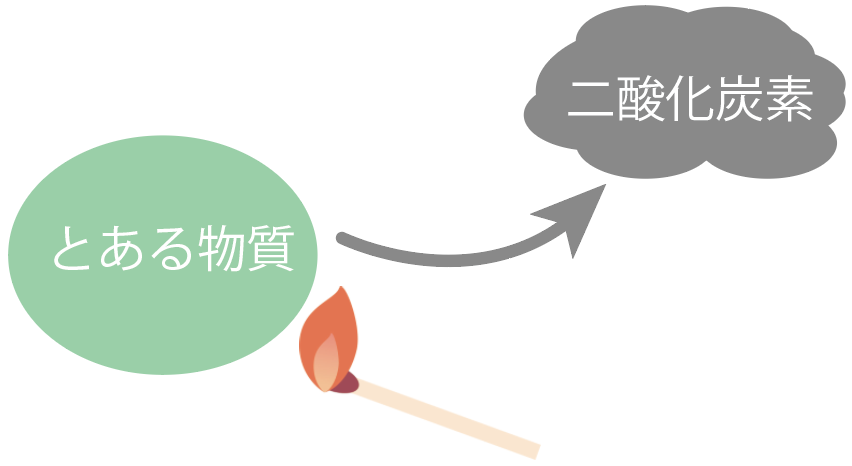
もし、ある物質を加熱したら、
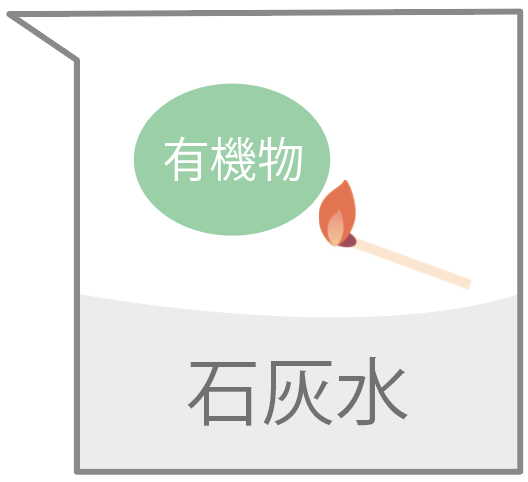
炎を出して燃えて、二酸化炭素ができたらそいつは有機物だ。
二酸化炭素ができたら、石灰水が白く濁るからすぐわかる。
一方、燃やしても二酸化炭素が発生しない場合。
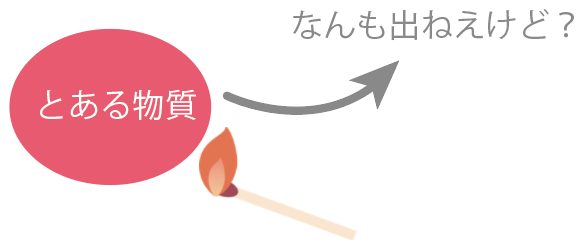
そいつは十中八九、無機物だ。
石灰水は白く濁らないはずね。
以上が、有機物と無機物の違いだったね。
最後に表にまとめておくよ。
| 炭素 | 燃やすと? | |
|---|---|---|
| 有機物 | あり(二酸化炭素、炭素は例外) | 二酸化炭素でる |
| 無機物 | なし | 二酸化炭素でない |
有機物と無機物は見た目では見分けられないから、ガスバーナーで加熱して反応を観察してみよう!
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。握りつぶしたいね。
中学生の理科の実験でいちばん使う実験器具。
それは、
ガスバーナー
だ。
ガスバーナーは一言で言ってしまうと、
ガスを使って火をつける道具のことだったね。

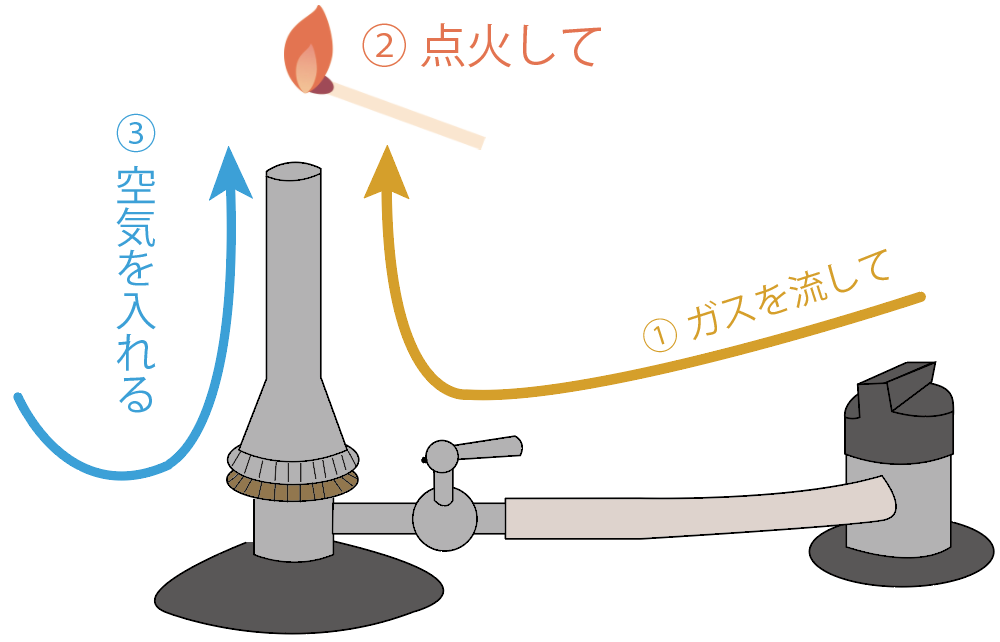
使い方は、
ガスを流して、マッチで点火して、空気をガスに混ぜて炎を安定化する
っていう感じだ。
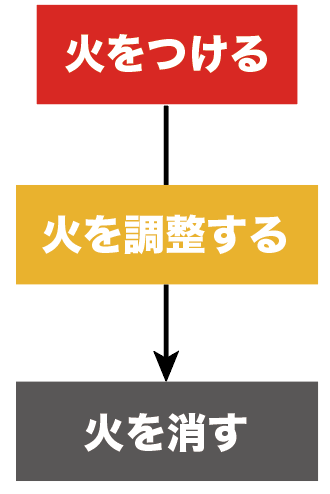
今日はもう一歩踏み込んで、ガスバーナーの使い方を詳しく、
の3つのステップの使い方をそれぞれ詳しくみていこう。
まずはガスバーナーの使い方の第一ステップだ。
このフェーズでは、ガスバーナーで火をつけていく方法を勉強していくよ。
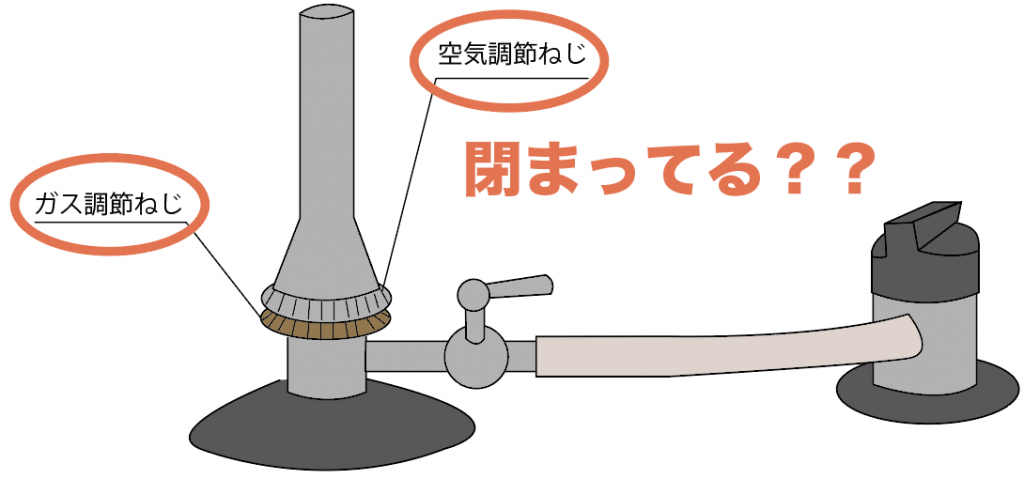
まずは、事前の安全チェック。
ここでは、ガスバーナーの2つのねじである、
の2つがしっかり閉まっているか確認してみよう。
なぜチェックしなきゃいけないのか??
それはズバリ、ガス漏れを防ぐためだね。
たとえば、2つのネジを締めてないとしよう。
この状態で、元栓とコックを開けちゃうと、開けた時点から周囲にガスが蔓延しちゃうことになるね。
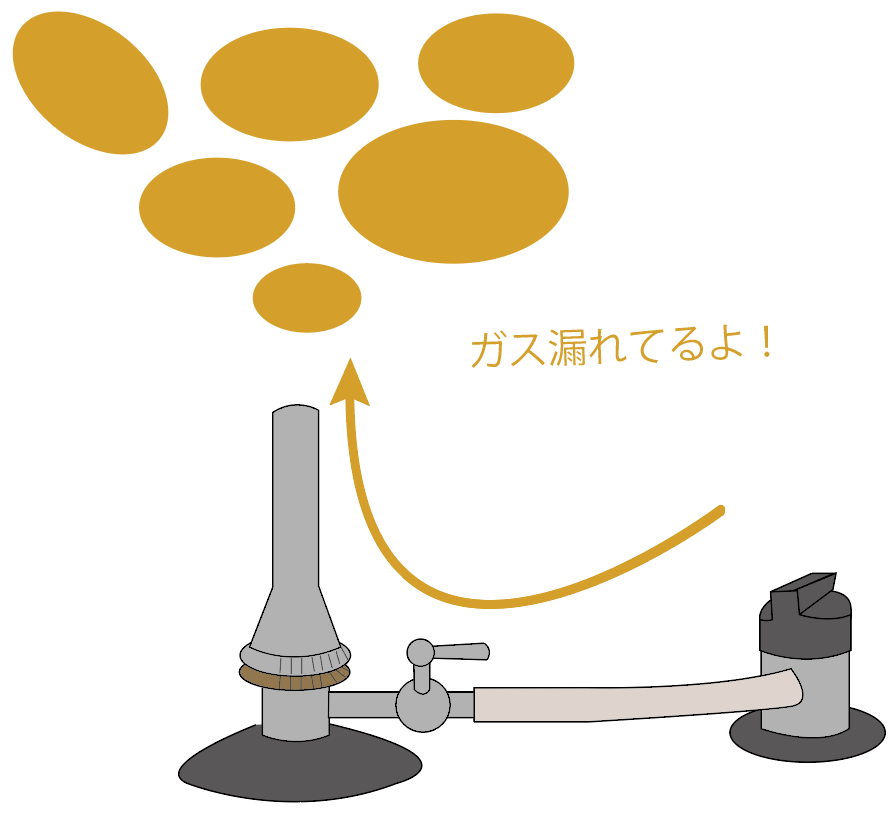
この時点で、マッチに火をつけると、自分が把握していないところを漂っているガスに火が着火してしまうかもしれないから危ないんだ。
だから、必ずガスバーナーを使う前は、
ガスを最後にガスを引き留めることになる「ガス調節ねじ」と、
ガスの火を強化する「空気調節ねじ」はしまっていることを確認してから始めよう。
続いては、ガスバーナーの元栓を開けてみよう。
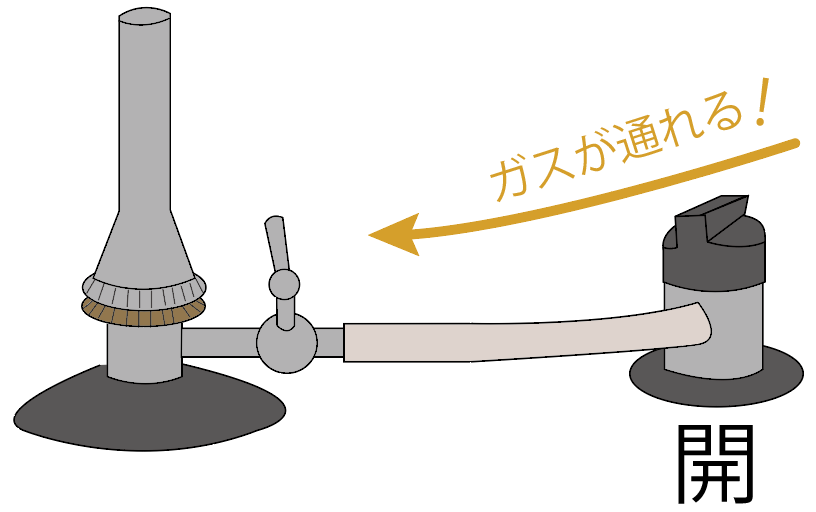
元栓を開けると、コックの手前までガスが流れてくるはず。
ガスバーナーのコックを開けよう。
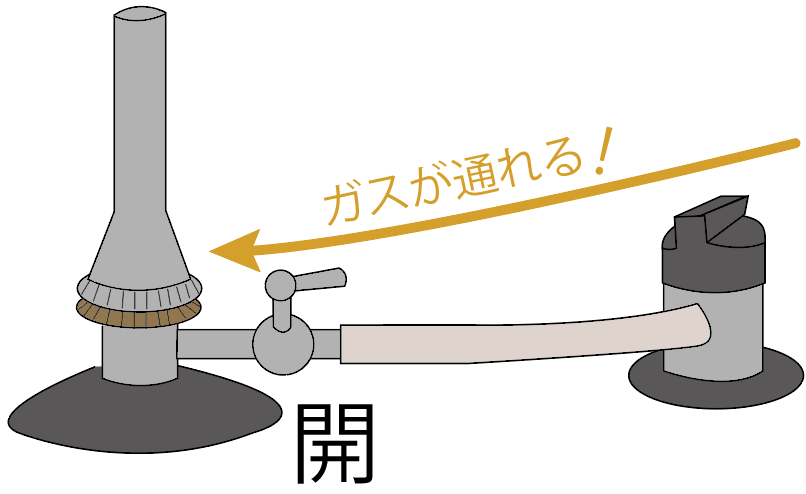
すると、ガス調節ねじの手前までガスが来てるはず。
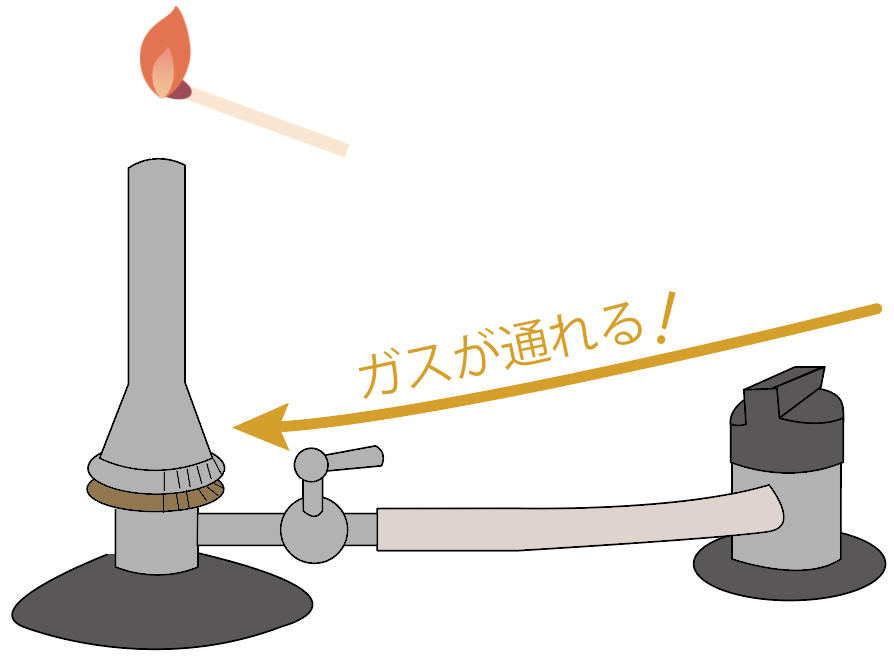
次に、マッチで火をつけてガスバーナーの口の近くに近づけてみよう。
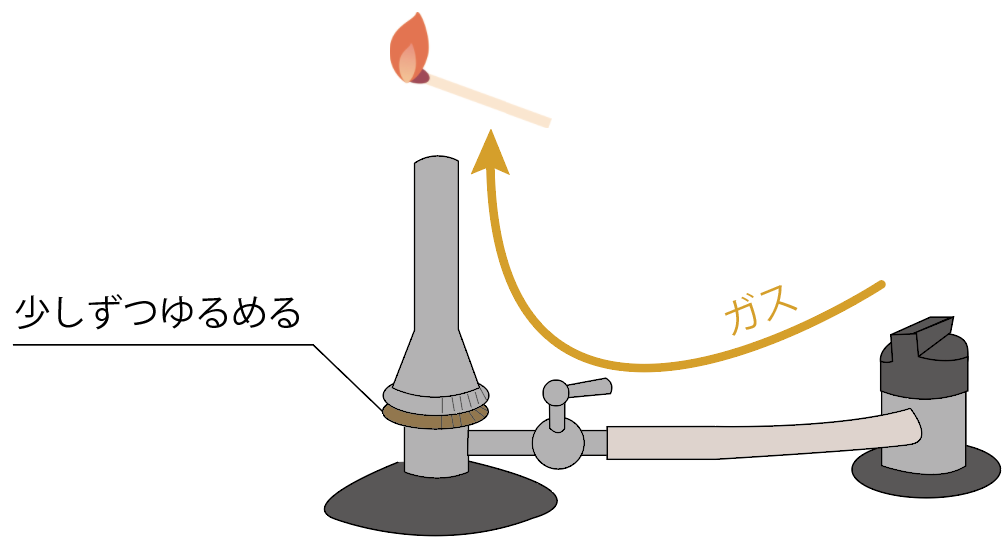
ガス調節ねじをゆるめよう。少しずつね。
すると、ガスがガス調節ねじより先に進むことになる。
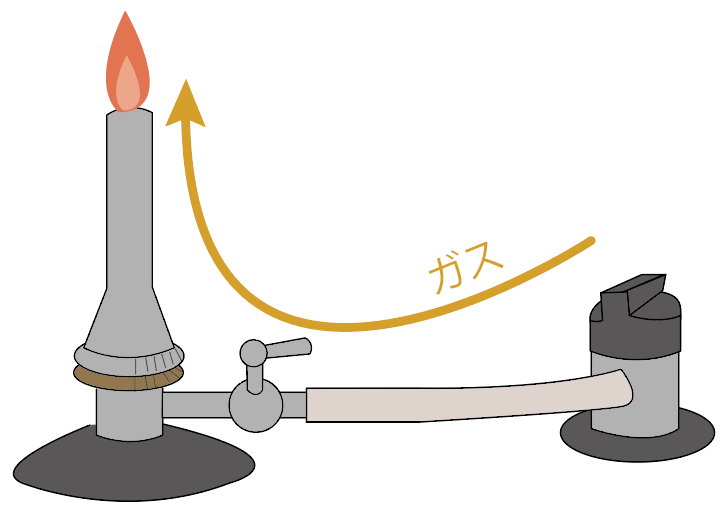
うまくいけば、マッチの火でガスバーナーに炎がつくね。
さて、ガスバーナーに灯した火を調整していくよ。
ここでは主に、
の2つを調整していくんだ。
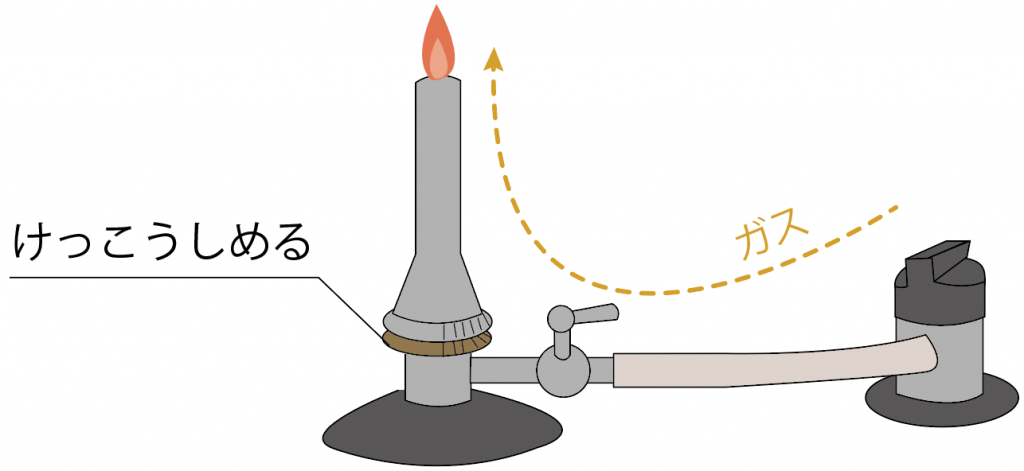
まずはガスの量を「ガス調節ねじ」を使って調整してみよう。
ガス調節ネジをしめれば、ガスの量が少なくなるから炎は小さくなるね。
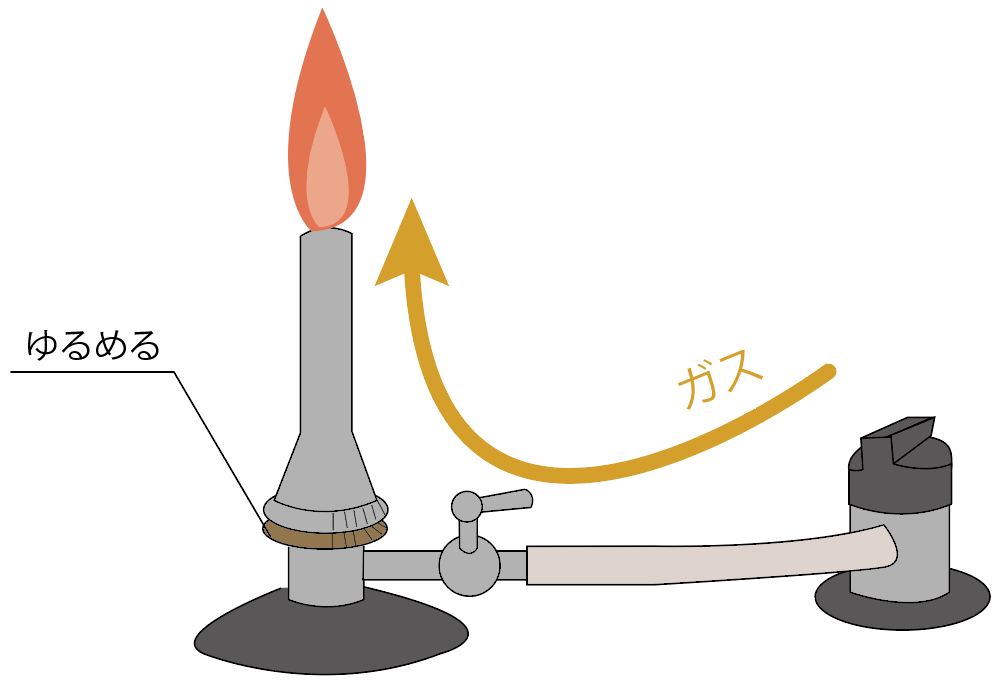
逆に、ガス調節ねじをゆるめていけば、ガスの量が多くなるから、ガスバーナーの炎は大きくなるよ。
次は、ガスに混ぜる空気の量の調整ね。
空気の量の調整には「空気調節ねじ」を回すんだったね?
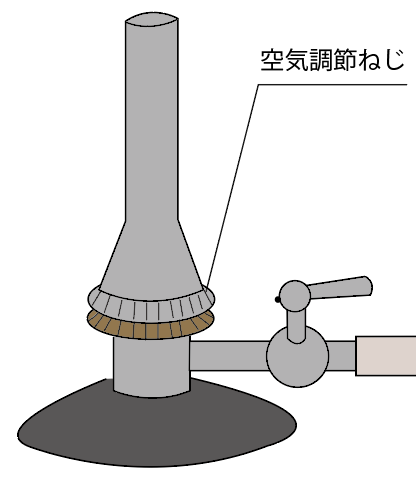
「ガス調節ねじ」が一緒に回らないように抑えながら、「空気調節ねじ」をゆるめていこう。
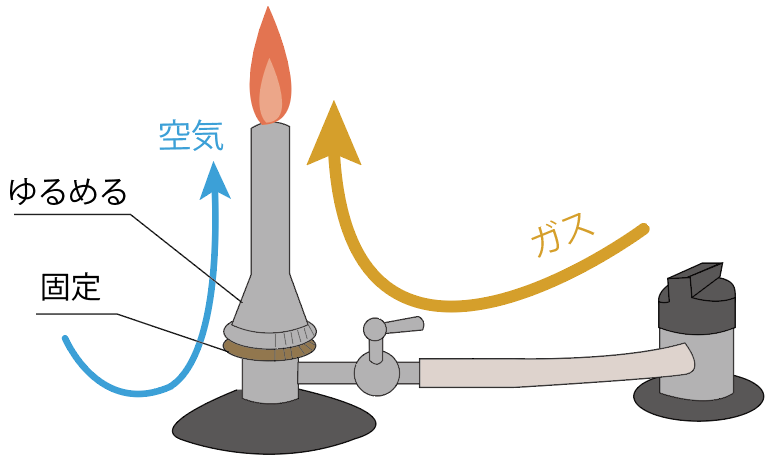
空気の量が十分ガスに混じると、炎の色が青色に変化するはず。
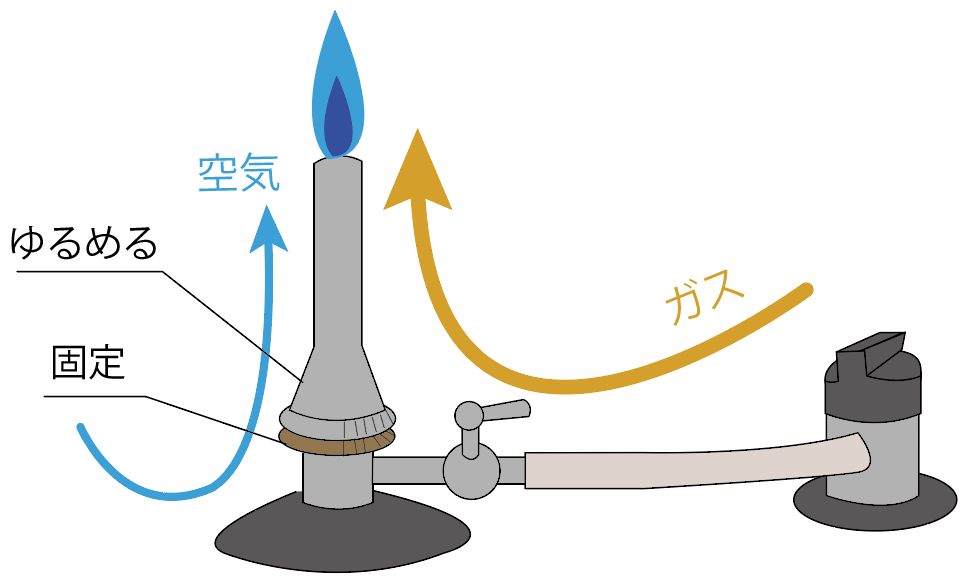
これは空気の酸素がガスに混じって、火が完全燃焼できている証拠。
この状態でものを熱すると、ススがつかないできれいにガスバーナーの炎を使うことができるんだ。
空気が足りないとオレンジの炎になっちゃうし、

空気を入れすぎると、ごおごおと音がなっているはず。
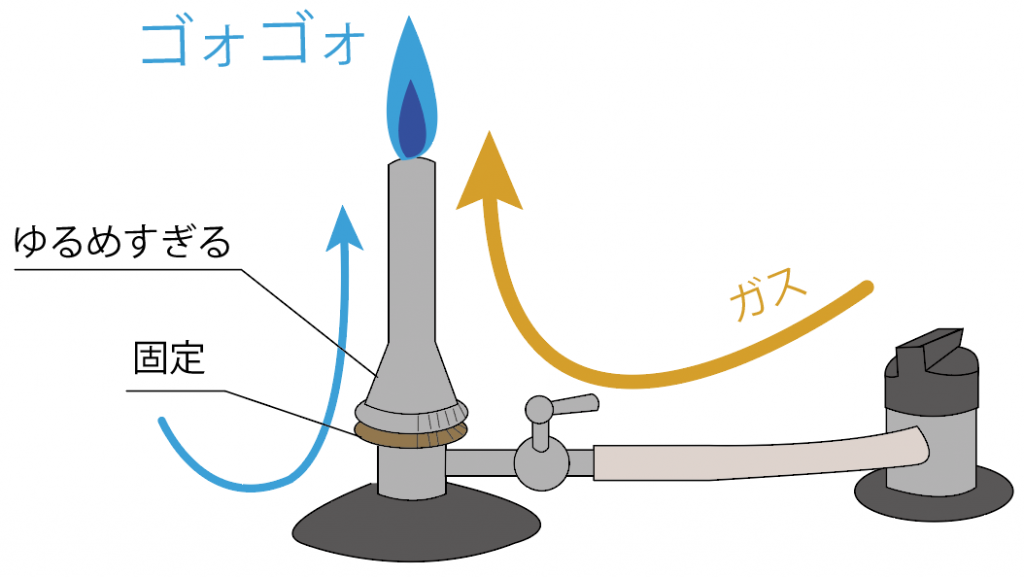
空気調節ねじを回して、丁度いい量の空気をガスに送り込んでやろう。

最後はせっかくつけたガスバーナーの炎を消しにかかるよ。
消し方はいたって簡単。
炎に近いところから徐々に元に戻していけばいいんだ。
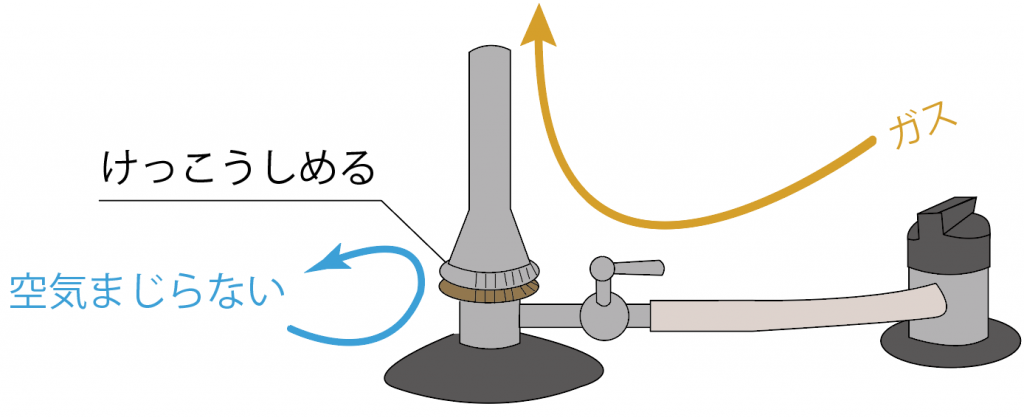
一番炎に近い「空気調節ねじ」をしめてやろう。
すると、炎の色が青色からオレンジ色に戻るはずだ。
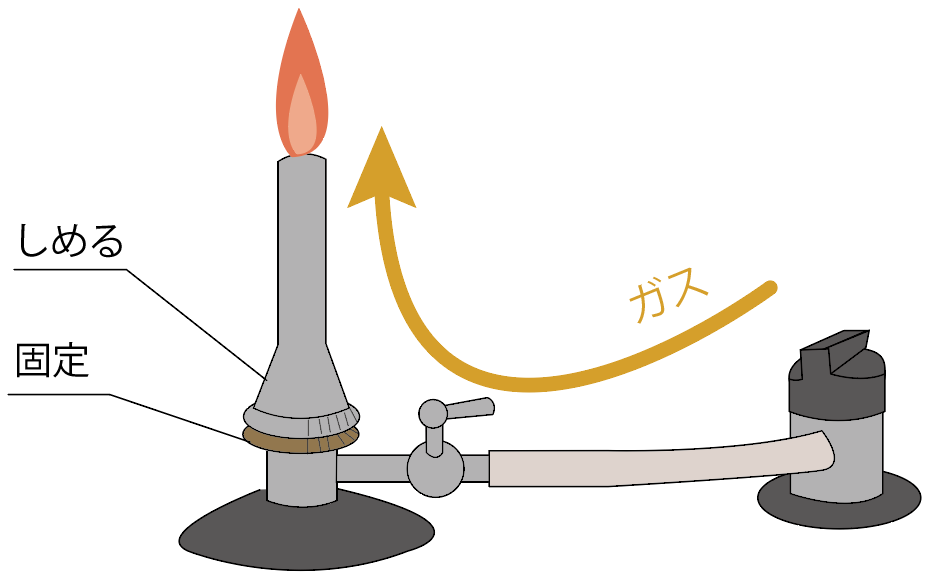
次は、ガス調節ねじをしめる。
すると、「ガス調節ねじ」より内側にガスが封じ込められるから、火が消えるはずだね。
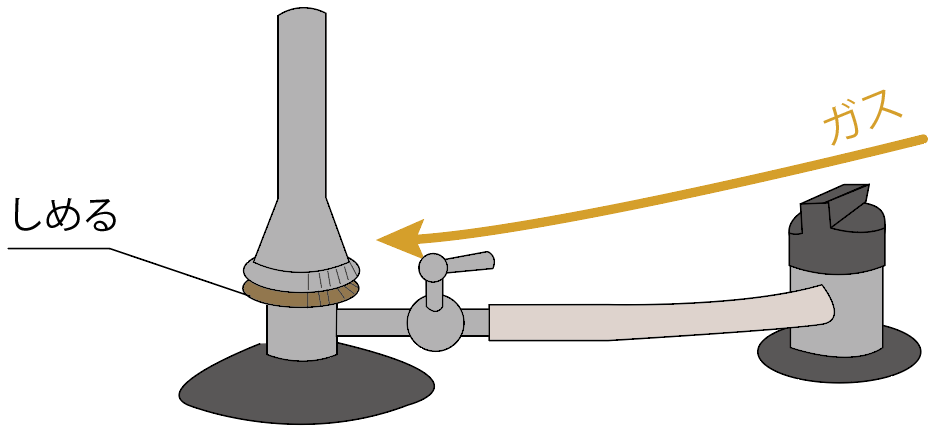
コックを閉じよう。
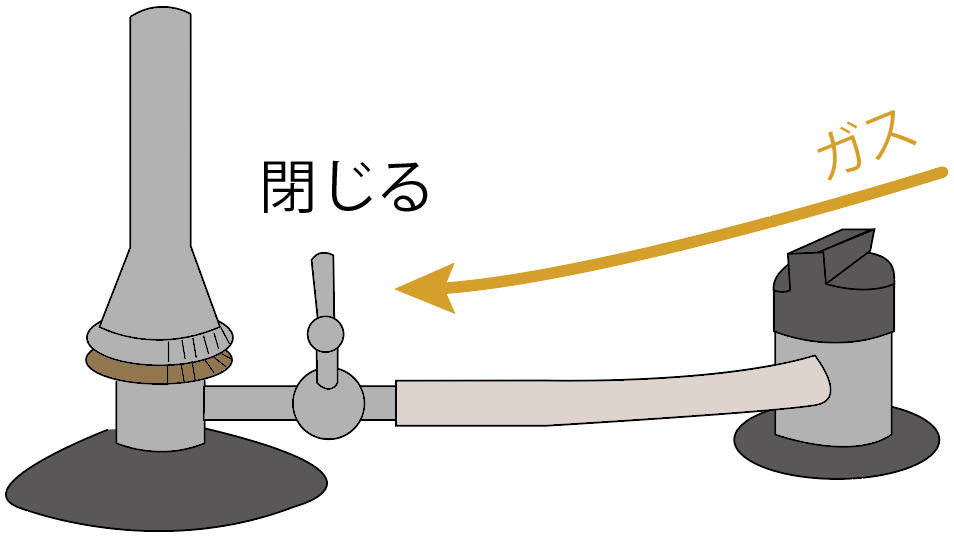
元栓を閉じよう。
これでガスの流れを元栓で食い止めてられてるはず。
事故の心配もなしだ。
以上が、ガスバーナーの使い方だ。
理科の授業では使い方を習うけど、やってることは次の3つ。

厄介なことに、このガスバーナーの使い方はテストで狙われやすい。。
テスト前によーく復習しておこう。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。カフェインで生きてるね。
中学1年生の理科ではいろんな実験器具を使っていくよね。
とかここまで使い方を勉強してきたけど、今日はもう一つ新しい実験器具が登場するよ。
その名も、
ガスバーナー
だ。

これは一言で言うと、
ガスを使って火をつける装置だ。

ガスをガスバーナーに流して、マッチで点火して、空気を入れて炎を安定化させて使っていくんだ。

早速、ガスバーナーの使い方を解説していきたいところだけど、今日はちょっとその下準備。
その前に知っておきたい、
ガスバーナーのパーツの名称と役割を勉強していこうね。
テストに出やすいガスバーナーの名称と役割を紹介していくよ。
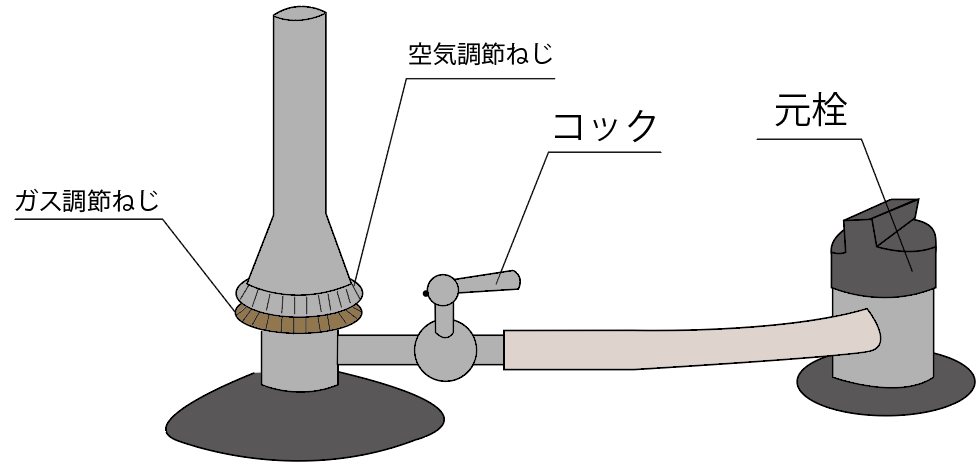
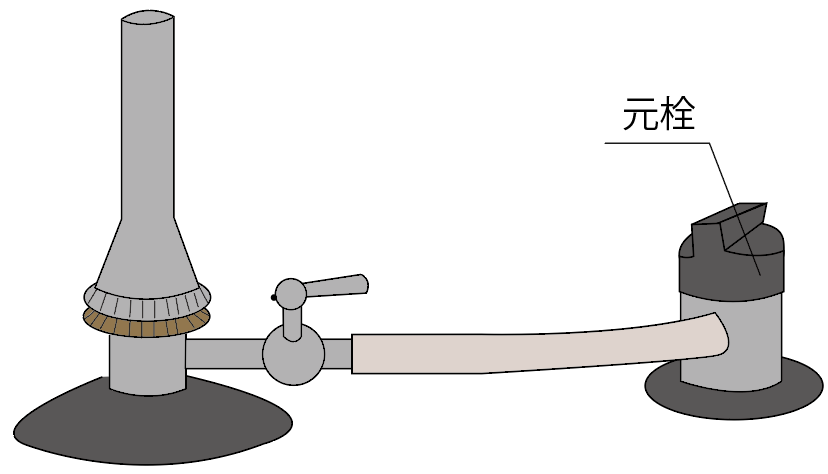
まず一つ目のガスバーナーの名称は、
元栓(もとせん)
だ。
こいつは何をやっているかというと、
ガスの流れをコントロールしているんだ。
元栓を閉めると、元栓より先にガスが進まなくなっているし、
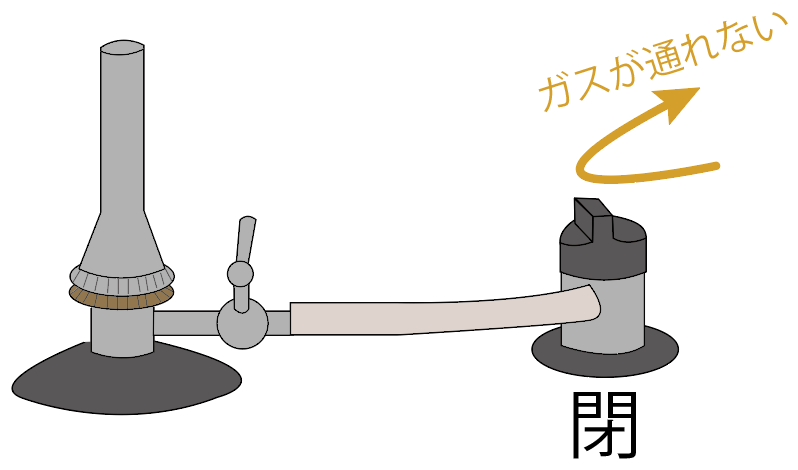
元栓を開くと、ガスを通すことができるんだよ。

いわば、関所の番人みたいなやつだ。
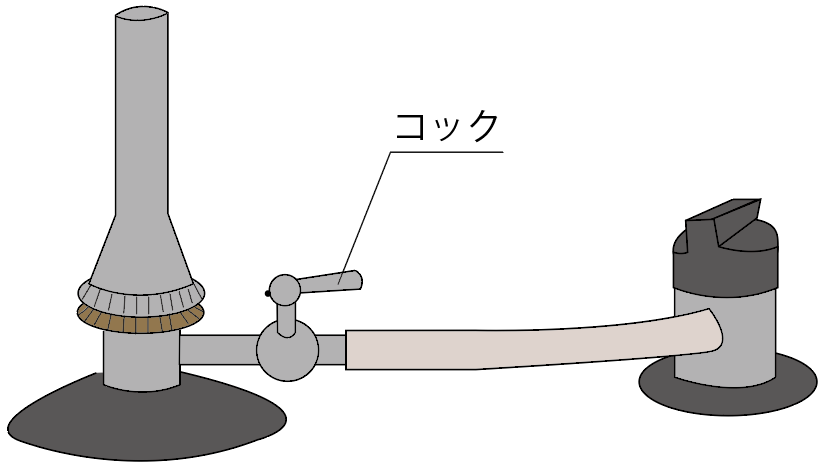
2つ目の名称は、
コック
だ。
これは料理人のコック(cook)ではなく、蛇口とか栓の意味のコック(cock)のことね。
こいつも元栓と役割は一緒。
ガスの流れをコントロールしているんだ。
コックを閉めると、コックより先にガスは流れないし、
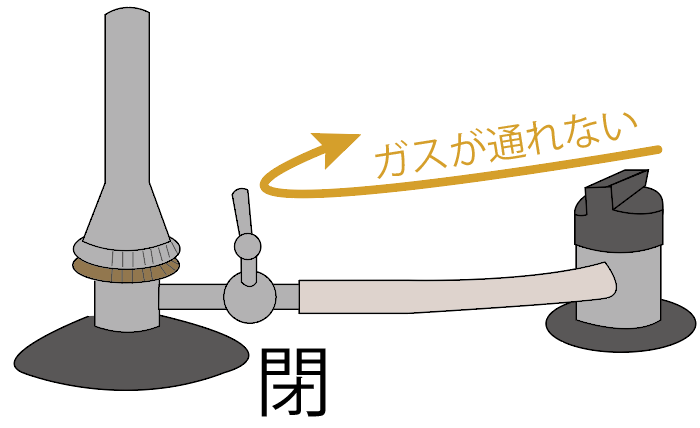
コックを開けると、コックより先にガスが進んでっちゃう。

元栓よりもガスバーナー側に近い位置にある栓。
ガスを通すか通さないか決める、第二の関門みたいな感じだね。
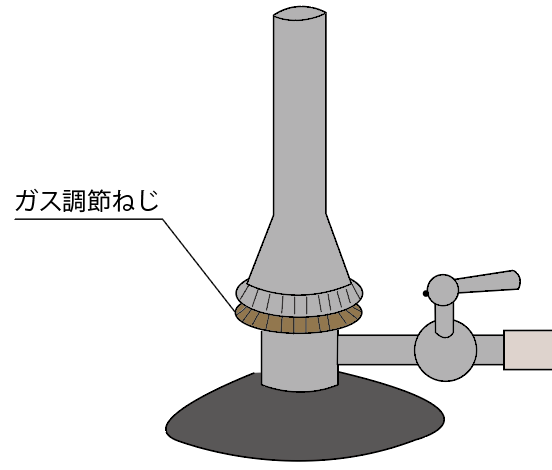
3つ目のガスバーナーのパーツの名称は、
ガス調節ねじ
だ。
元栓・コックと同じで、ガスの流れをコントロールしてるんだけど、もっと進んで、
ガスを流す量をコントロールできるパーツなんだ。
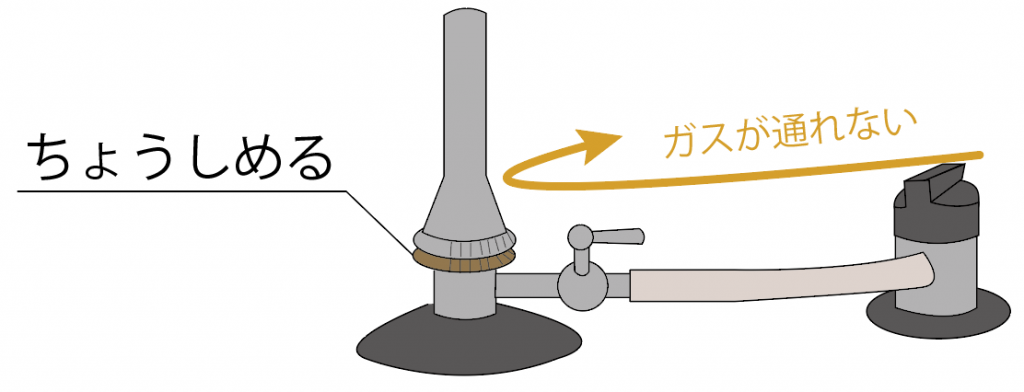
しめまくれば、ガスはねじより先はガスが流れなくなるし、
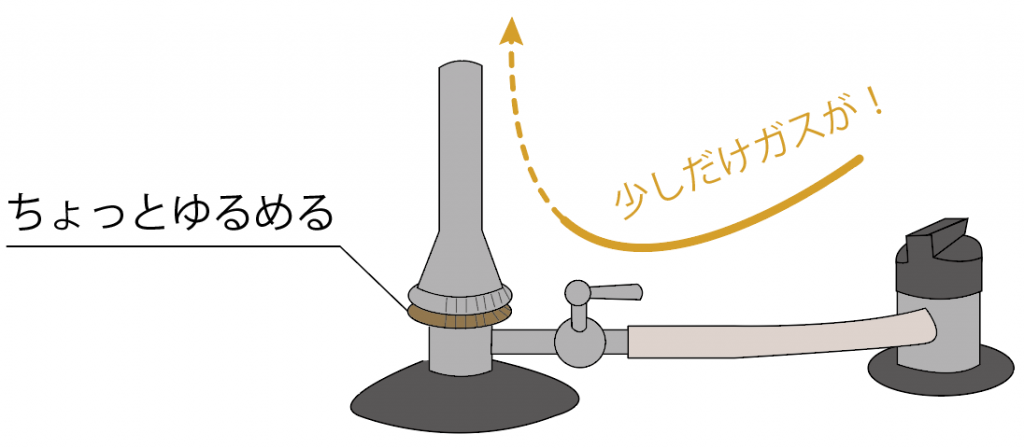
ちょっとでも緩めればガスは流れ出す。
しかも、どれくらいのガスを流すかの量が決められるから、ガス調節ねじを緩めまくると、ガスの量が増えて火が強くなるんだ。
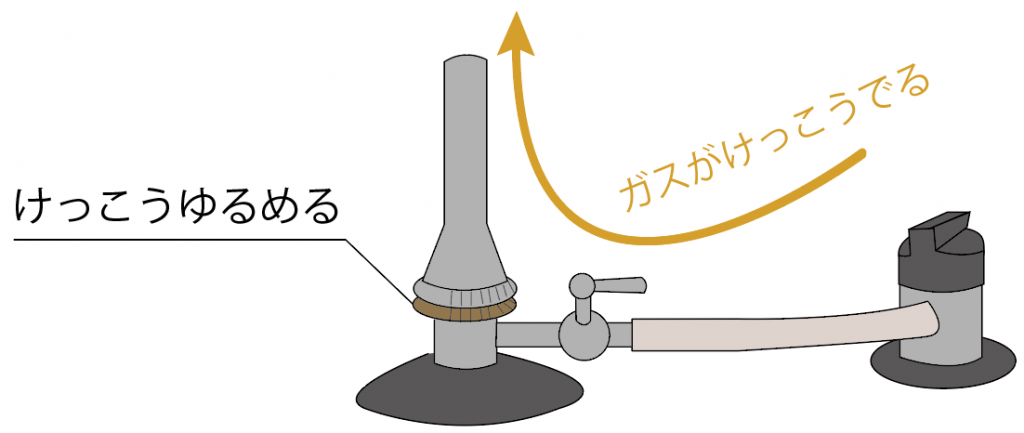
こんな感じで、ガス調節ねじでは、
っていう2つの役割があるわけね。
関所と司令塔が合体したようなもんだ。

最後のガスバーナーのパーツの名前は、
空気調節ねじ
だ。
このパーツの役割は簡単で、
ガスに混ぜる空気の量をコントロールするパーツだ。
開きまくれば、大量の空気がガスに混じることになるし、
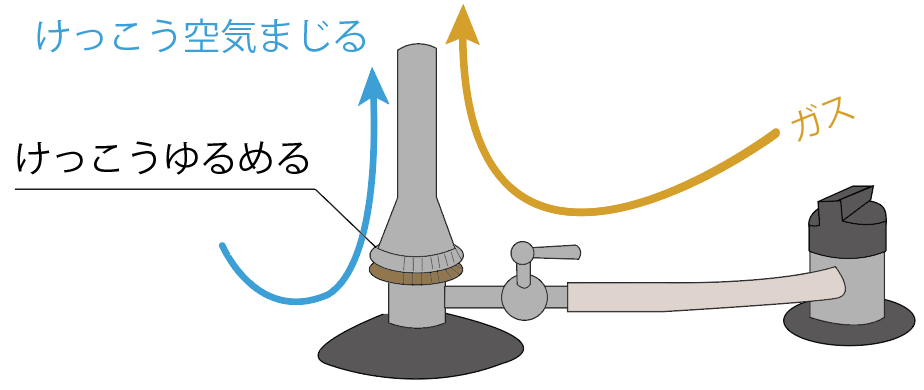
ぎゅうぎゅうに締めれば空気がガスに混じらなくなる。
ガスに空気を混ぜてガスバーナーの炎を安定するときに活躍するパーツだね。
ここまでのパーツは主に、ガスの流れをコントロールする奴らばかりだったけど、空気調節ねじは一味違う。
ガスに空気を混ぜて、ガスをドレスアップするメイクアップさんみたいなパーツだ。
と、以上がガスバーナーの名称と役割だったね。
せっかくだから、最後に簡単に復習しておこう。
元栓は、ガスの流れをコントロール(通すか通さないか)していて、

コックも元栓と同じく、ガスの流れをコントロール(通すか通さないか)という役割があって、

「ガス調節ねじ」は、ガスの量をコントロール(どれくらい?)していて、

「空気調節ねじ」はガスに混ぜる空気の量をコントロール(炎を安定化)しているんだったね。

次回はいよいよガスバーナーの使い方を解説していくよ。
そんじゃねー
Ken
こんにちは!この記事を書いてるKenだよ。水滴と戦ってるね。
中学理科の実験ではいろいろな実験器具を使っていく
中でも使い方が複雑でよくわからないのが、
上皿天秤(うわざらてんびん)
という道具だ。
「電子てんびん」っていう便利な道具があるのにもかかわらず、古典的な実験器具を使わないといけないんだよ!?
ってキレそうになる気持ちはわかる。
だけど、コツさえつかんでしまえば、上皿天秤(てんびん)の使い方も簡単。
やっていることは、電子天秤と変わらない
ということに気づけるはずなんだ。
ってことで、今日はこの上皿天秤の使い方をわかりやすく解説していくよ。
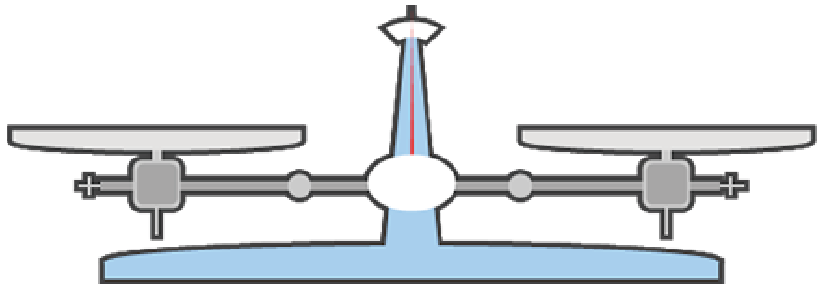
上皿天秤とは、簡単にいうと、
「あるもの」の質量をはかる道具のこと。
ひとつの皿のうえに、質量をはかりたいものを置いて、
もう一個の皿には「分銅」という重りを置いていくんだ。
そして、上皿天秤(てんびん)のメモリの針がちょうど真ん中に来たとき。
左右の皿に置いた2つのものの質量は等しいってことになるよ。
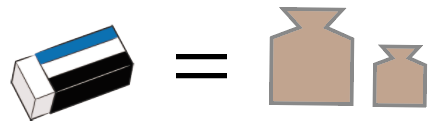
以上、ざっくり上皿てんびんの使い方を開設したけど、もうちょっと詳しく見ていこうか。
この上皿天秤の使い方には次の2つがあるんだ。
まず一つ目の上皿てんびんの使い方。
それは、
ある物体・物質の質量をはかりたいときの使い方だ。
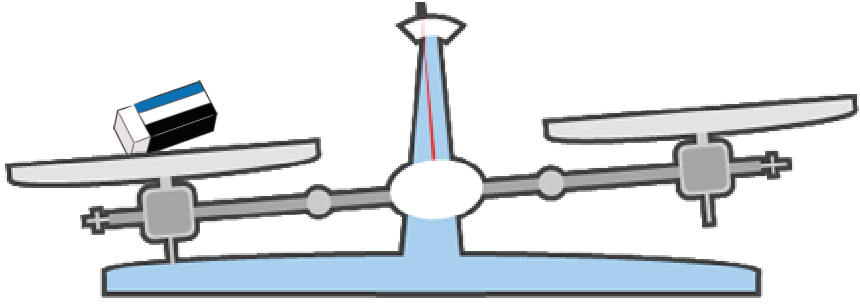
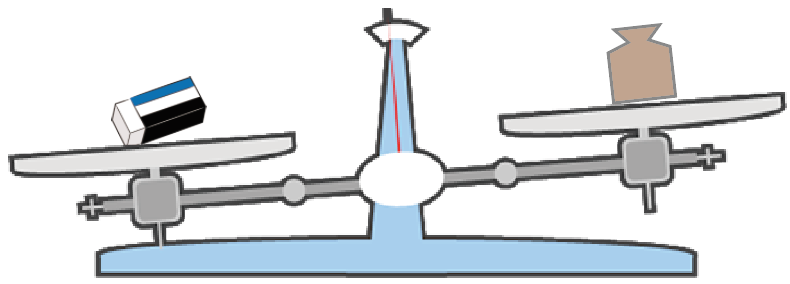
たとえば、この消しゴムの質量をはかりたいときとかね。

消しゴムケースにも本体にも重さが書いてない。
こういう時は、上皿てんびんを使って質量を測ってみるのが一番だ。
まず一つ目にやることは、上皿てんびんを水平な場所におくことね。

理科の机とかでいいね。
次は、左右の皿に何ものせてないときに釣り合ってるのか確認していくよ。
具体的に何をすればいいのかというと、上皿てんびんのメモリのフレが左右等しくふれているかチェックすればいいんだ。
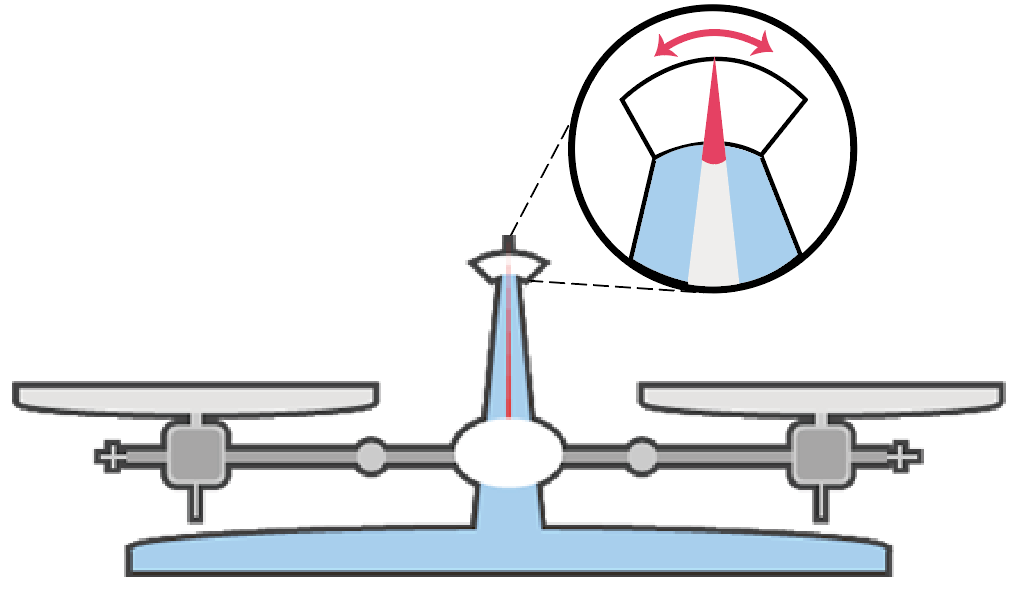
もし、針のフレが左右等しくない場合は、上皿てんびんについてる調整ネジで調整していくよ。
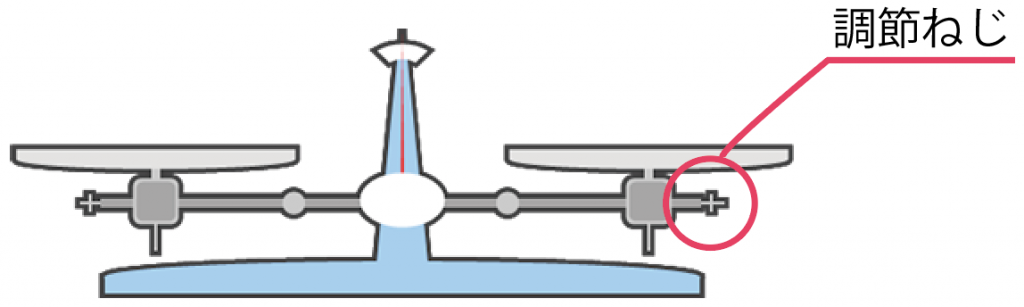
このネジは何をしているかというと、
上皿てんびんの腕の左右の長さを微調整してくれているんだ。
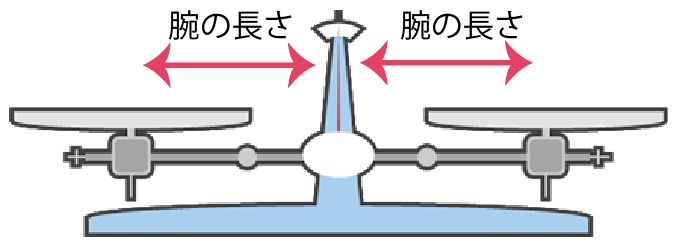
腕の長さをずらしてあげることで、左右の釣り合いを調整できるんだね。
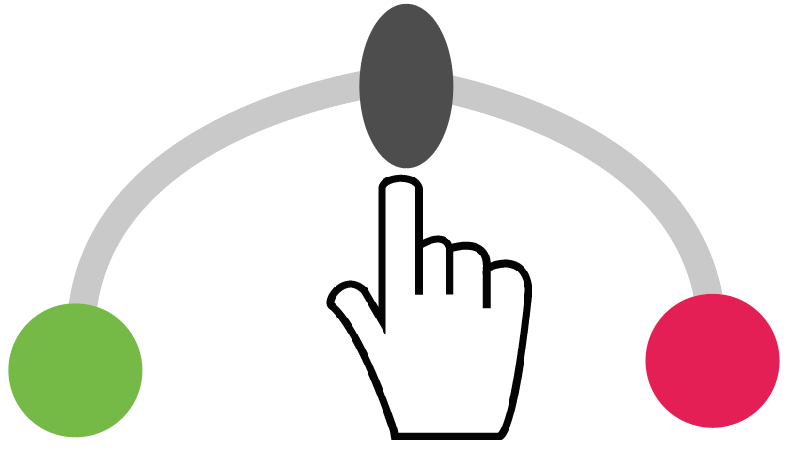
これは「やじろべえ」を考えるとわかりやすい。
市販のやじろべえは左右の重りは同じ重さだから、腕の左右の長さは等しいと釣り合うはず。
だがしかし、手作りしたやじろべえがもし、ちょっとしたミスで右のほうが重くなってしまったらどうする??
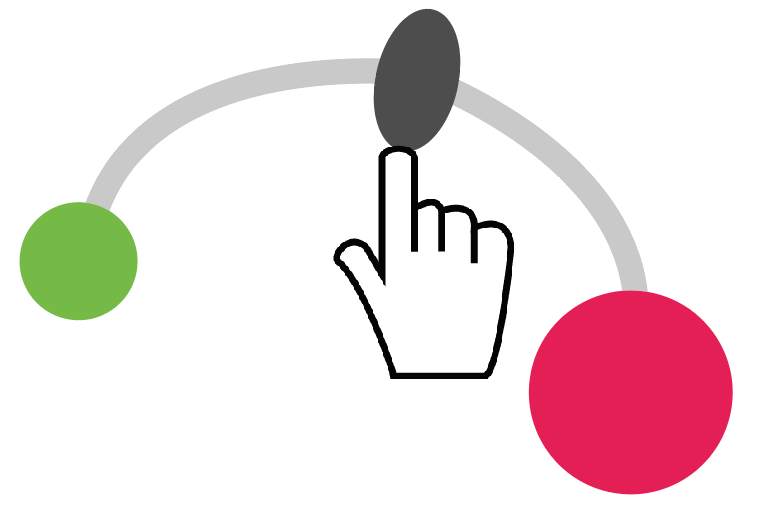
そう。
そうだよ。
右の腕を短くすれば、やじろべえは釣り合うはずなんだ。
上皿てんびんでも同じことをやっているわけ。
調節ねじを回すことで、左右の腕の長さを微調整してるんだ。
何ものせてない状態で天秤が釣り合えば準備完了だ。
いよいよ上皿てんびんにものを置いていくよ。
まずは、質量をはかりたいものを置くんだ。今回の例でいうと、消しゴムだね。

次は、分銅だ。
分銅を上皿てんびんの逆側の皿の上に置いてあげよう。
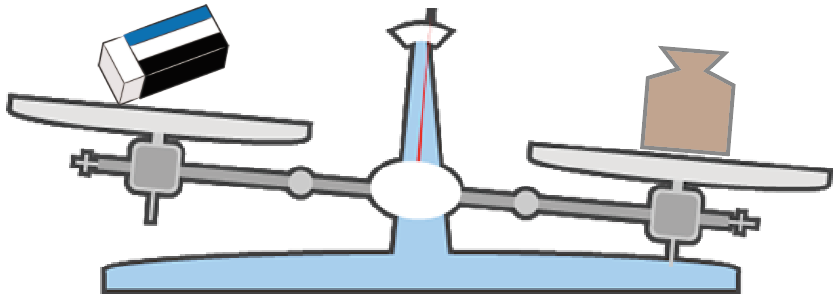
ここでポイントなのは、
はかりたいものより少し重たそうな分銅をおくんだ。
なぜなら、重たい分銅から試すことで、分銅をおく回数を減らすことができるからね。
さて、ちょっと重そうな分銅を置いてみたかな??
このとき、多分、おそらく、次の3つのパターンの結果にわかれると思うんだよね。
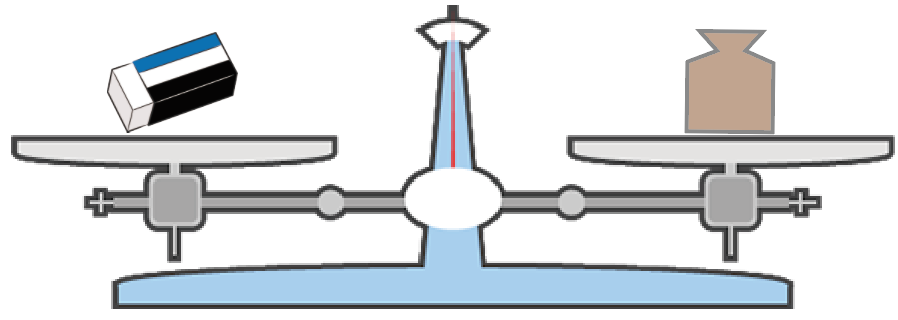
いきなり適当に選んだ分銅で上皿てんびんが釣り合っただって!?
そんな時もありだ。
勘が優れているってことにしておこう。
この時、既に上皿てんびんが釣り合ってしまっているので、
消しゴムの質量は最初に載せた分銅の質量に等しいってことになる。
分銅が15gのものだったら、消しゴムも15gってわけ。
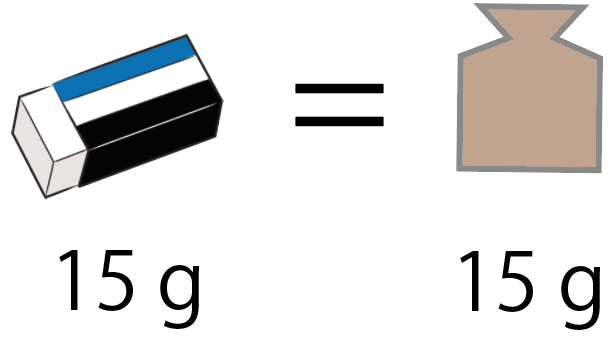

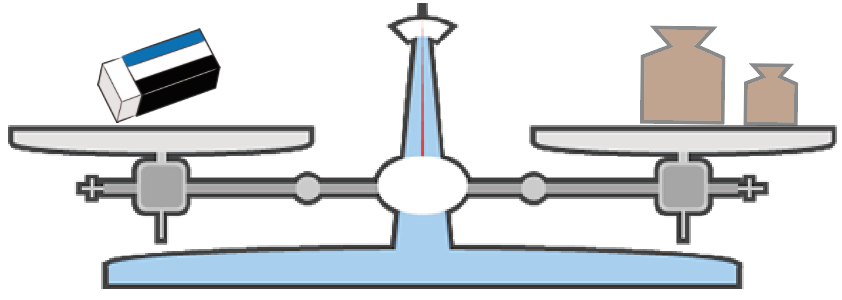
狙い通り、消しゴムより重い分銅を置けた!
そんな時は、分銅を1段階軽いものにチェンジだ。
そして、分銅の方が軽くなる重さを見極めるんだ。
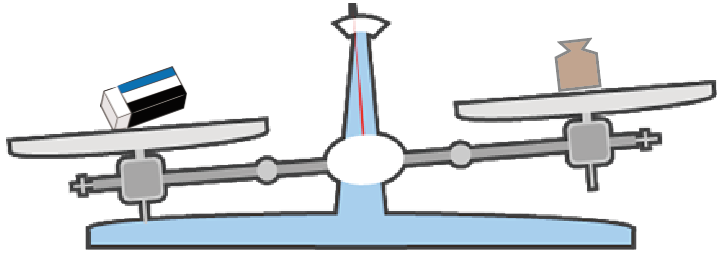
分銅の方が軽くなったら、今度はその分銅に加えて、もう一つ小さい分銅を足してみる。
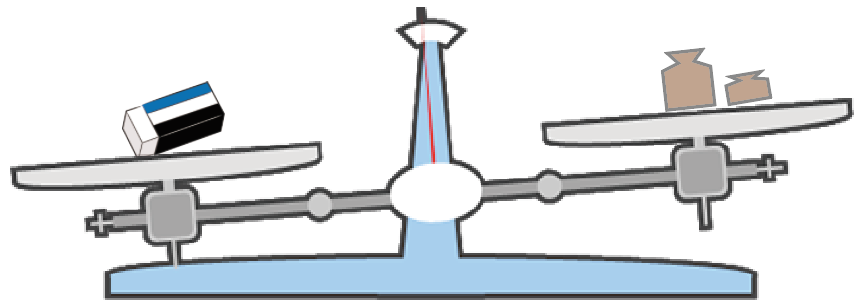
って感じで、じわじわと上皿てんびんが釣り合うまで小さな分銅たちを付け加え続けてみよう。
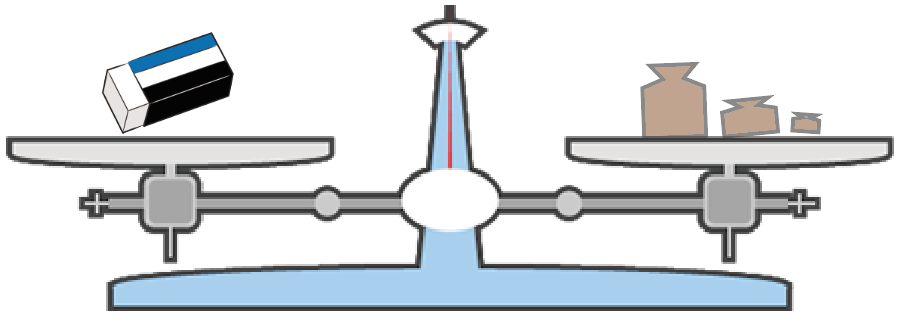
もし、21.4g分の分銅を置いて、上皿てんびんが釣り合った場合は、
消しゴムの重さは21.4g ってわけ。
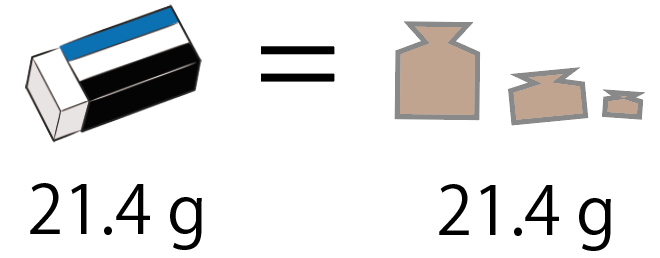
最後のパターンは、最初に載せた分銅の方が軽かった場合だ。

ちょっと勘が外れちゃったね。
この場合、まず、消しゴムよりも重い分銅を見つけることに専念しよう。
なぜ、軽い分銅を細かく足していっちゃダメなのかというと、終わりが見えないからだ。
消しゴムが何gよりは軽いっていうことがわかっていないと、分銅を足しまくって地道に果てしなく釣り合うことを目指すことになっちゃう。
これはつらい。
だから、まずはぐっとこらえて、
分銅の方が重くなる、分銅の重さを探してみるんだ。

もし、見つかったら、さっき紹介した「最初の分銅の方が重いパターン」の通りにやってみよう。
分銅を小さいものにして、さらに小さい分銅を付け足したり、引いたりすればオッケー。
以上があるものの質量をはかりたいときの上皿天秤の使い方だ。
しっくりきたかな??
二つ目の上皿てんびんの使い方は、
物質をある重さだけ取り出したいパターンだね。
たとえば、実験で使う薬品を必要なグラム数取り出したいときなんかに使うね。
今日は、砂糖水を作るために、5.8g正確に取り出したいときのシチュエーションを想定してみよう。

まずは、上皿てんびんを水平な場所にセッツ!

メモリが左右に等しく触れているかチェック!

触れてなかったら、調節ねじを回して腕の長さを微調整して合わせてみて。

次は、薬品をさらに置くために敷くシートの、
薬包紙
を上皿てんびんにセッティングしていくよ。
ここでの注意点は、薬包紙は左右両方の皿の上に置くということ。
できれば、薬品側だけにおきたいんだけどね。
片側だけに薬包紙を置くと、上皿てんびんが傾いちゃうんだ。
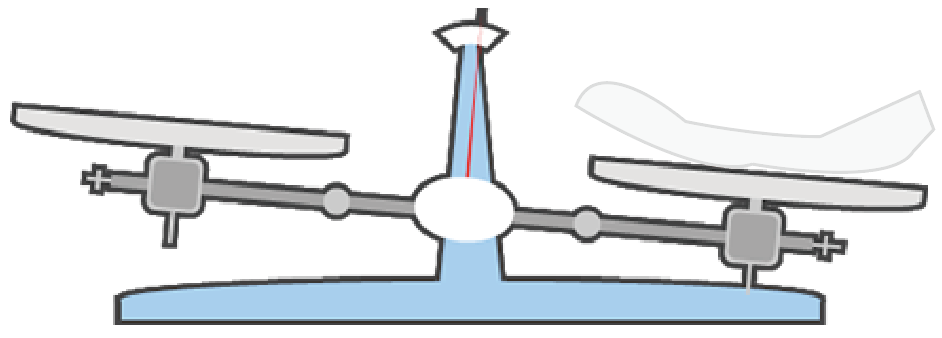
なぜなら、薬包紙にも質量があるからね。
だから、ここは平等に左右の皿に同じ薬包紙を置いてあげるんだ。
上皿てんびんを釣り合わせるためにね。
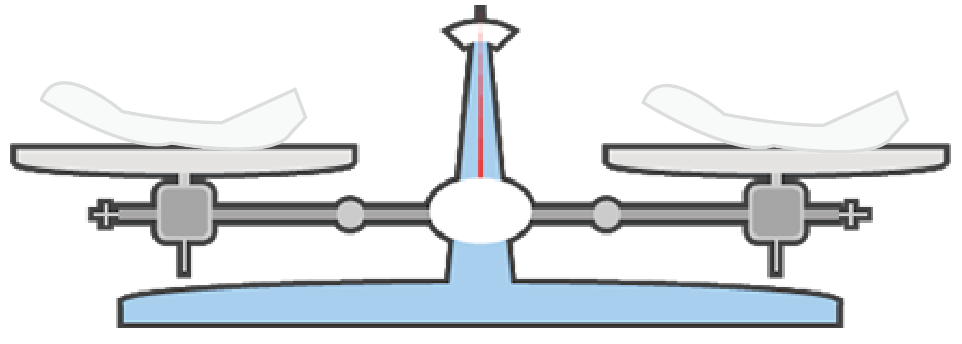
次はいよいよ分銅の出番だ。
薬品を取り出したい質量の分だけ、分銅を片側の皿の上に置いてみよう。
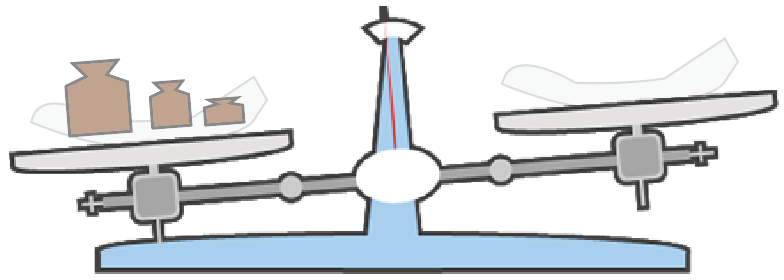
今回の砂糖の場合、5.8g取り出したかったから、5.8g分の分銅を置けばいいのさ。
あとは、少しずつ物質を皿に置いていくだけ。
ヨット、
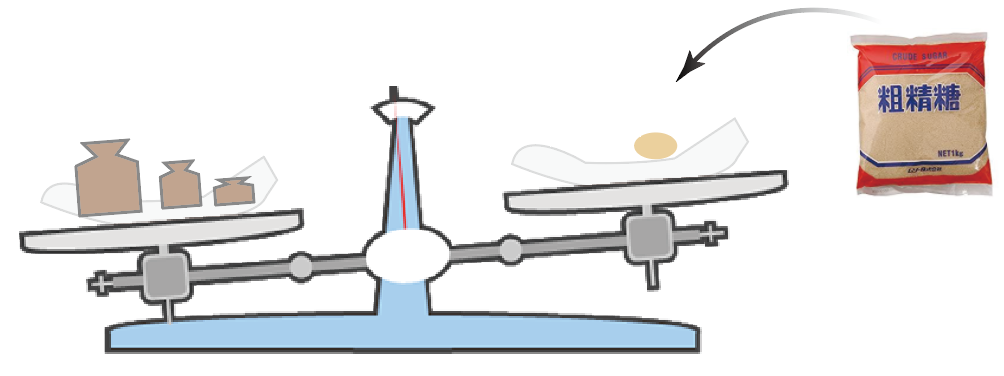
セット、
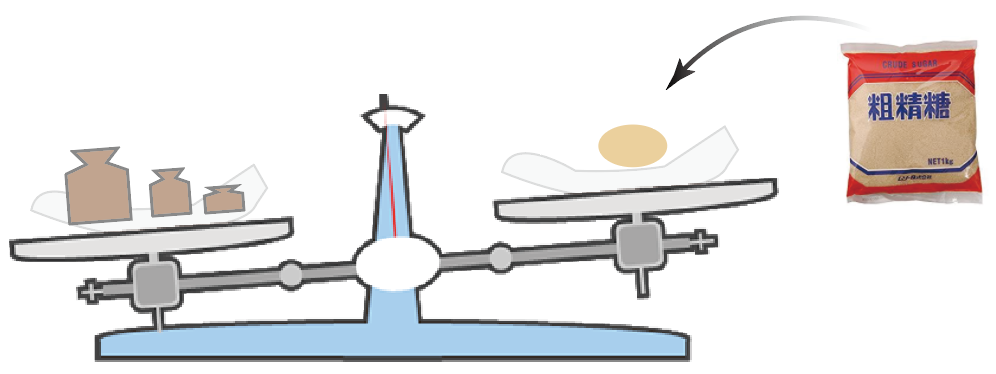
ホット、
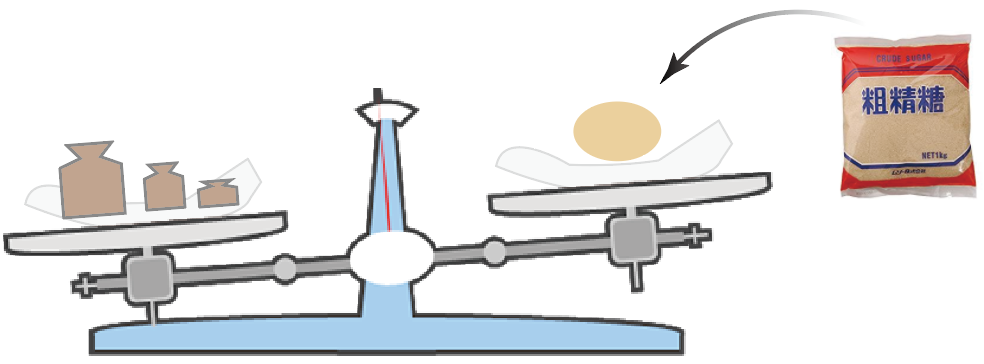
はい、釣り合った〜〜
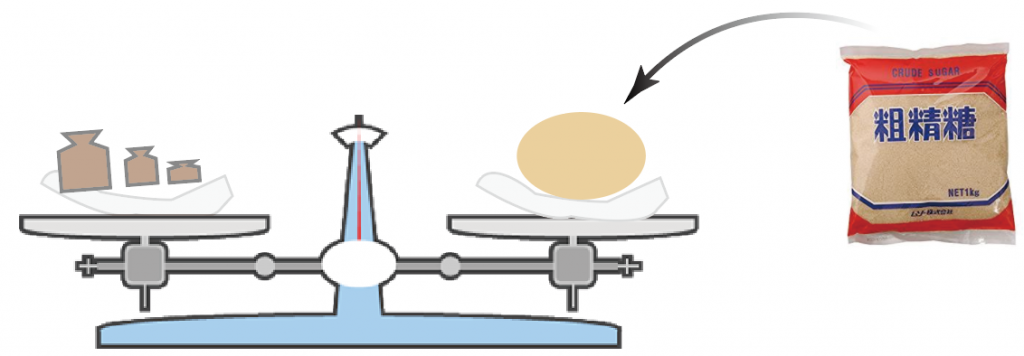
ここで終了。
無事に、5.8g 分の砂糖が取り出せたことになるね。
あとは、煮るなり焼くなり砂糖を好きにしてくれ。
ここまでが上皿てんびんの使い方。
だいたい、水平な場所にセットして、

左右が釣り合うように腕の長さ調整して、

分銅を釣り合うまで変えまくればよかったね。

やったね!
これで上皿てんびんマスターだ!
・・・・・・って言いたいところだけど、1つだけ注意点があるんだ。
それは、
左右のどっちに分銅か物質をおくかって問題だ。
別にどっちでもいいんだけど、一般的には、
利き手側に、操作するものを置いてるね。
たとえば、使い方の1つ目の「ある物質の重さをはかる」場合だったら、
分銅を入れたり出したりしてるよね??
だから、分銅は利き手側の皿におく。
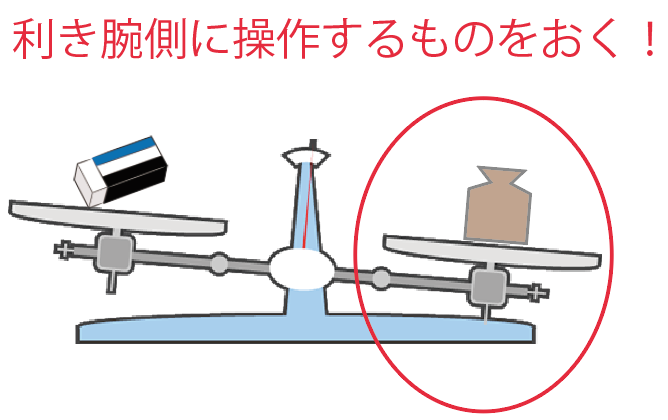
その方が操作しやすいからね。右利きだったら右の皿、左利きだったら左の皿だ。
逆に、2つ目の使い方の薬品編では、
薬品などの物質を付け足したりして操作してたよね?
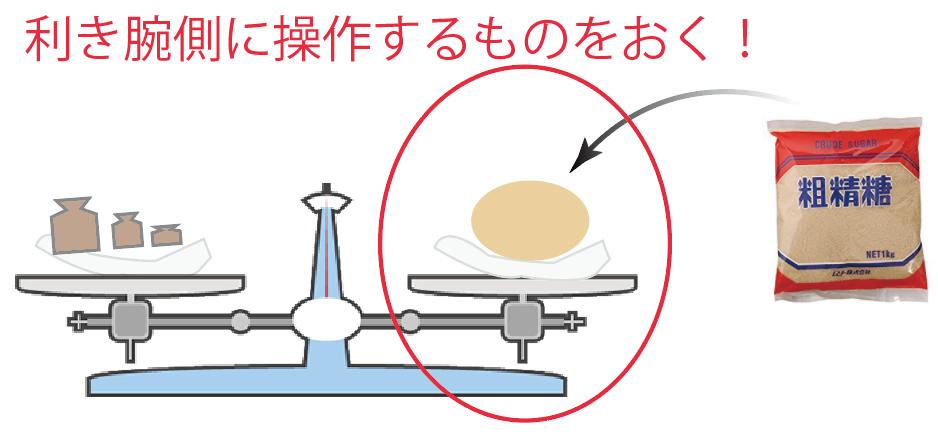
この場合は、薬品を利き手側に置いた方が作業がしやすい。
上皿てんびんを使うときに、
「どっちにどれを置くんだっけ!?汗」
ってなったら、自分の本能に従うのが一番。
皿の上に置いたり、取り出したりする物体が利き手側にあった方が作業しやすいでしょ!
こんな感じで、上皿てんびんの使い方終わり!
しっかりマスターして実験でヒーローになろう。
じゃあね!
Ken