こんにちは!この記事をかいているKenだよ。ローヤルゼリー注入したね。
中学理科で光の勉強をしていると、
乱反射(らんはんしゃ)
という言葉を勉強していくよね??
乱反射とは、
表面がデコボコしている物体に光を当てたときに、いろんな方向に反射すること
をいうんだ。
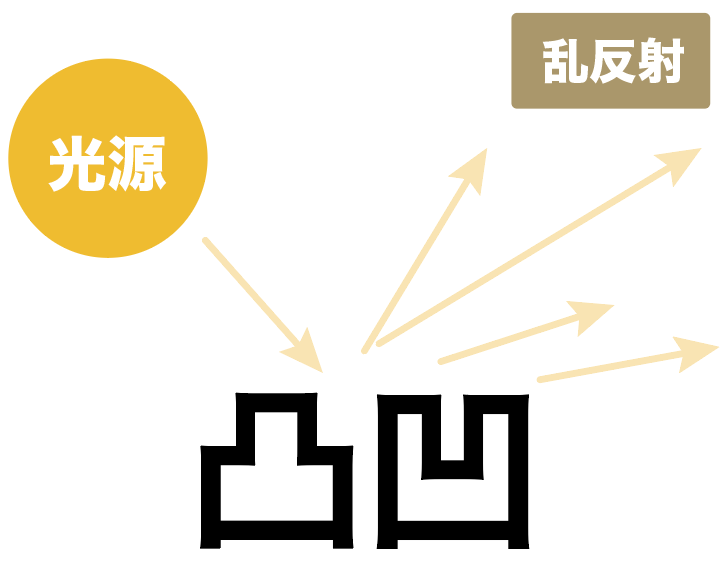
たとえば、ちょっとデコボコしているフランスパンに光を当てているシチュエーションを想像してくれ。

光源が一つしかないとき、このパンを見たかったらどこに移動する??
光の反射の法則を勉強したやつは、
「入射角と反射角が等しくなる位置に移動すれば見える!」
って答えるかもしれないね。
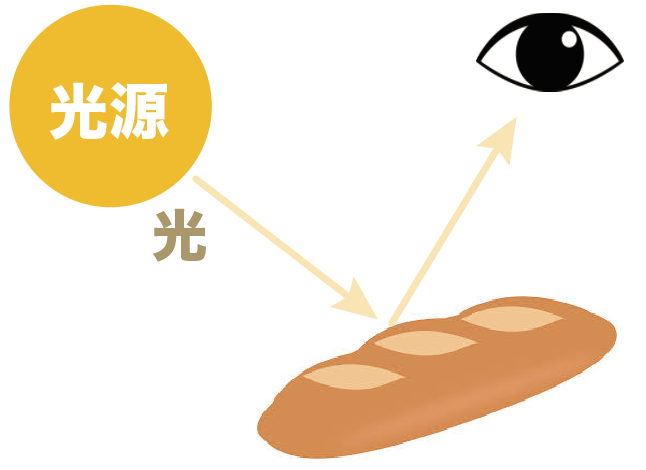
いや、確かに入射角と反射角が等しくなる位置に移動しても見えるんだけど、それだけじゃああない。
フランスパンの表面はデコボコしてるから、光をあてると乱反射が起きる。
つまり、一つの方向からの光源しかなくても、いろんな方向に光が進んでいくんだ。
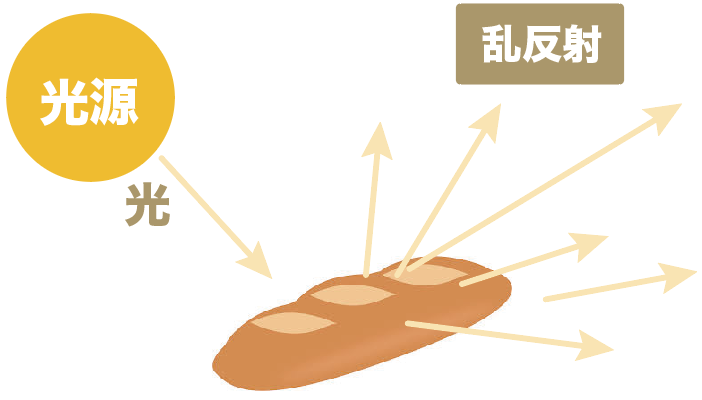
だから、ぶっちゃけ、フラスパンの近くにある程度いればどの方向からも見えるはずだ。
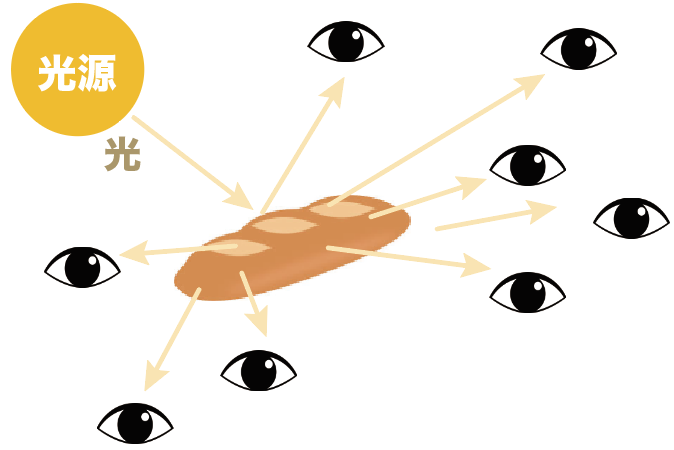
って感じで、光源からの光をデコボコの表面がいろんな方向に反射してしまう乱反射。
一見、「光の反射の法則」を無視しているように思うけど、じつは、
ちゃんと光の反射の法則に従っているんだ。
光の反射の法則は、
入射角と反射角が等しい
だったね。
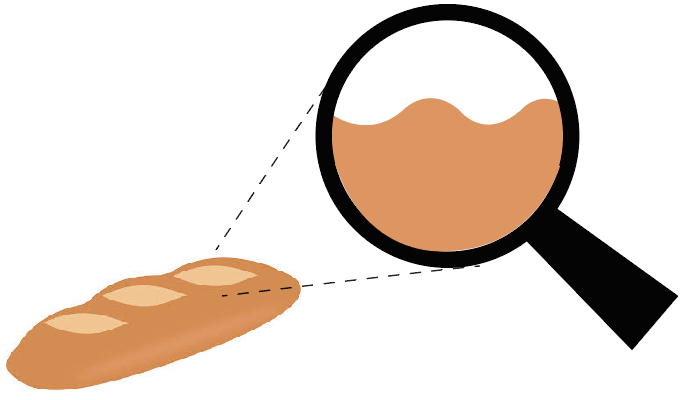
さっきのフランスパンを見てみよう。
フランスパンの表面を虫眼鏡で拡大してやると、こんな感じでびっくりするぐらいデコボコ。
光源からフランスパンに光を当てたときは、こんな感じで、ひとつひとつの光の道筋が「光の反射の法則」に従ってしっかりと反射しているんだ。
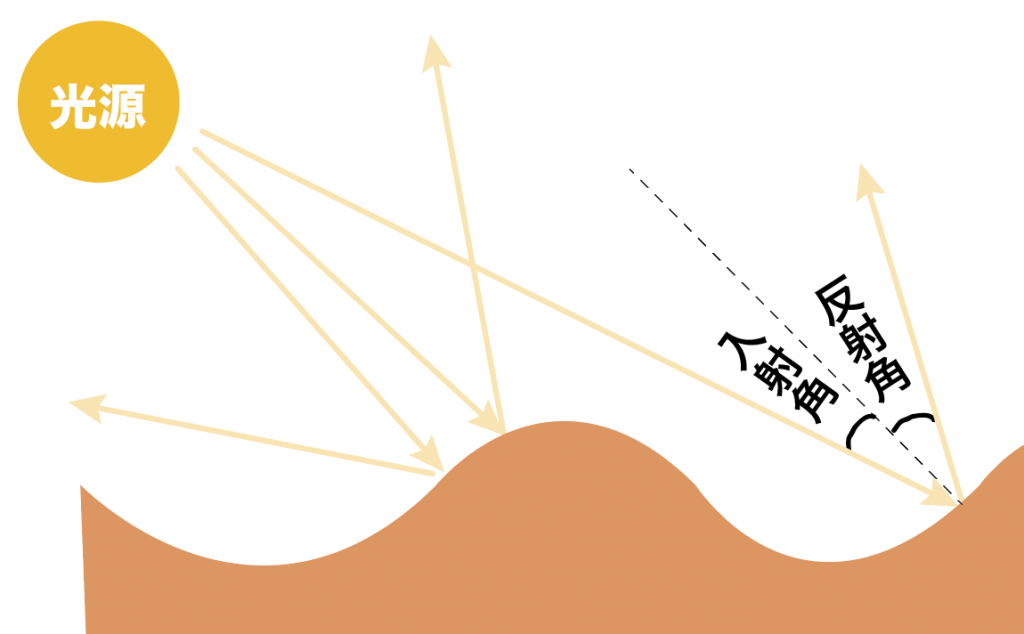
だから、表面がデコボコしている物体に光をあてると乱反射しているのね。
ちょっとしっくりこなかった時は「光の反射の法則」から復習してみよう。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。ペッパー、最高。
中学理科では、
光の反射の法則
というものを勉強していくよ。
光の反射の法則とはズバリ、
鏡に光を当てたとき、入射角と反射角が等しくなる
っていう法則なんだ。
ふむふむ・・・なるほどね・・・
えっ。
「入射角」と「反射角」って初めて耳にした言葉だって!?
そうだね、じゃあ今日は光の反射の法則を理解するために、入射角と反射角の復習から始めよう。
光の反射の法則の基礎となる、
を解説していくよ。
この2つのキーワードは、両方とも、
鏡に光を当てたときにできる角度のこと
なんだ。
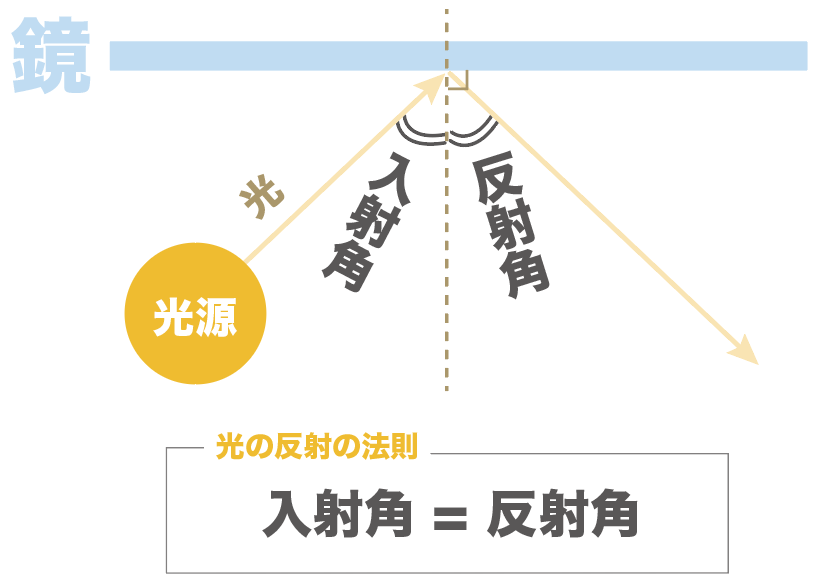
光源から光を発射しているシチュエーションを想像してくれ。
まず入射角からね。
入射角とは、
鏡に光を当てたときに、「入ってくる光の道筋」と「鏡に垂直な線」がつくる角度のこと
なんだ。
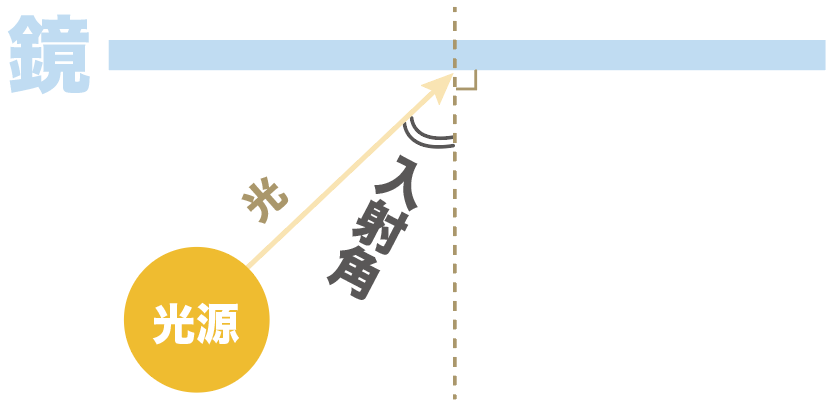
光線がある物体に当たることを「入射」っていうから、入射(光源から鏡へ当たるとき)するときの、鏡に対する角度を「入射角」と呼んでいるんだ。
一方、反射角とは、
「反射した光の道筋」と「鏡に対して垂直な直線」との角度のことをいうんだ。
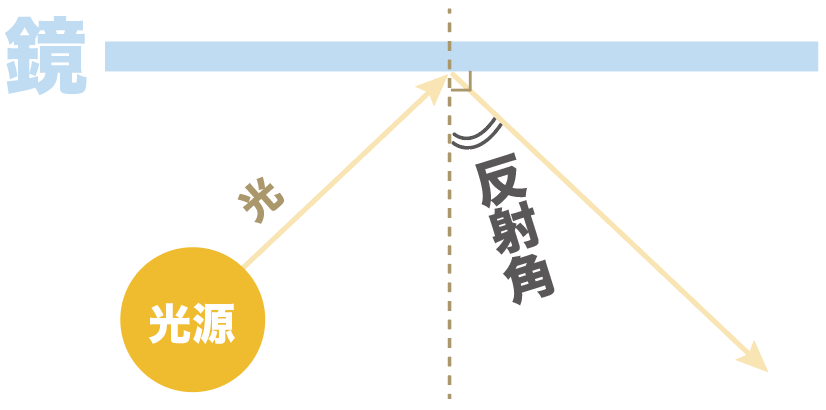
どう?入射角と反射角の違いもしっくり来たかな。
光の鏡に対する角度っていうのは同じなんだけど、入ってくる光との角度のなのか、反射する光との角度なのかが異なるんだ。
ここまでで、
の2つの意味はだいたいわかったね。
で、一番最初に紹介した光の反射の法則とは、
鏡に光を当てたとき、入射角と反射角が等しくなる
っていうやつだったね?
そう、文字通り、鏡に光を当てたとき、
入射角=反射角
になるんだよ。

たとえば、鏡に光を当てたとき、入射角が36度だったとしよう。
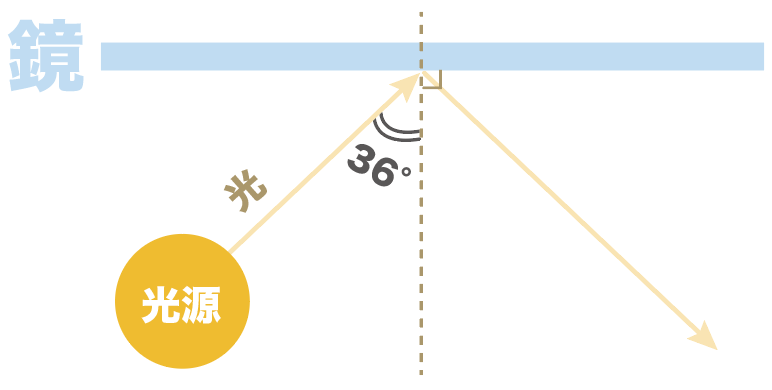
このとき、光の反射の法則より、反射角も36度になるんだ。
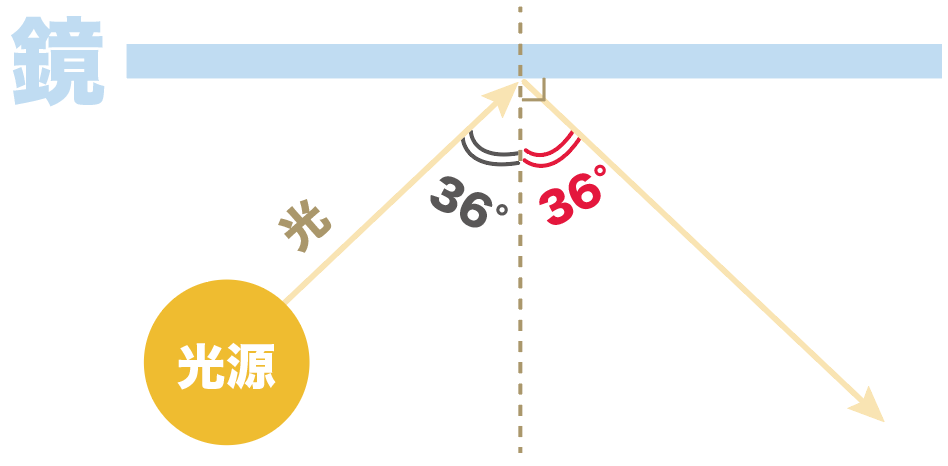
なるほどね。
これで光の反射の法則は終わり!
次は光の屈折の法則を勉強してみよう。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。水、有料だね。
中1理科では「身のまわりの現象」という単元で、
光の進み方
を勉強していくよね。
ここでは文字通り、光がどんな感じで進んでいくのかを勉強していくんだけど、この単元を理解する基礎となるのが、
っていう3つのキーワードなんだ。
こいつらさえ押さえておけば、テストで慌てることはない。逆に知っていると武者震いしてくるはずだ。
そこで今日は、光源・光の反射・光の直進をわかりやすく解説していくよ。
よかったら参考にしてみて。
まず基礎中の基礎。
光源とは、
自分から光を発している物体のこと
だよ。

たとえば、身近な例でいうと、太陽とか、蛍光灯とか、スマホとかパソコンかな。

もちろん、世界には光源じゃないものだってあるよ。
光源じゃないのは、たとえば、紙でできた教科書とか、人間とか、牛丼とか、牛とか、草とか、かな。

光源じゃない物体は光を発してないんだ。
続いて、光の反射だ。
光の反射とは、
光が物体の表面に当たってはね返えること
をいうんだ。
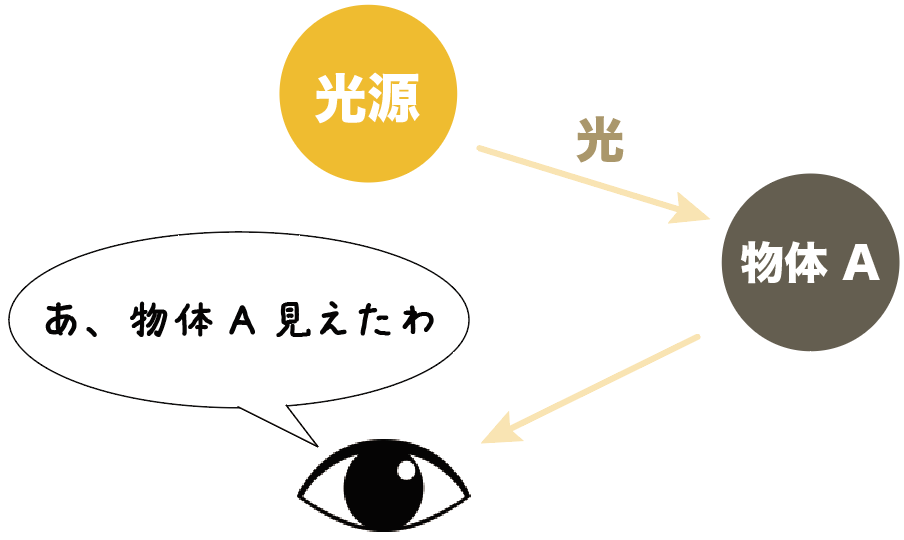
さっき紹介した光源じゃないものたちを、ぼくら人間の目で見ることができるのは、
光源から発せられた光が、物体の表面に反射して、目に届くからなんだね。
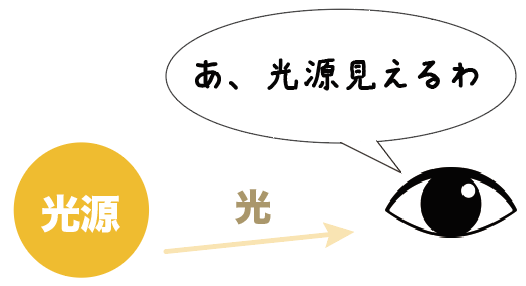
光源の物体は光の反射を利用しなくても目に見えるということだ。
お次は「光の直進」だ。
光の直進とは、
光源から発射された光がまっすぐに進むこと
をいうんだ。

光源から出た光は、こんな風にクネクネしないし、

一筆書きの絵を描いたりしない。

まっすぐ進むんだ。

以上が、
の3つのキーワードだよ。
最後に復習しておこう。
光源とは、自ら光を発している物体で、

光の反射とは、物体に光が当たってはね返えること。

光の直進とは、光が光源から出たらまっすぐ進むことだったね。

どれもこれも中学の光の勉強で基礎となる用語たちだからしっかり押さえておこう。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。ジンジャー、注入したね。
中1理科の身のまわりの物質では、
蒸留(じょうりゅう)
という言葉を勉強していくよね??
中学理科の授業で「蒸留」はテストにでやすいだけじゃなくて、蒸留の実験も行われたりするから、蒸留とは何かを理解しておくに越したことはないんだ。
そこで今日は、中学理科で勉強する蒸留とはなにかをわかりやすく解説していくよ。
よかったら参考にしてみて。
ズバリ、蒸留とは、
ある「液体」の物質を「気体」にして「液体」にもう一回戻して取り出すこと
なんだ。
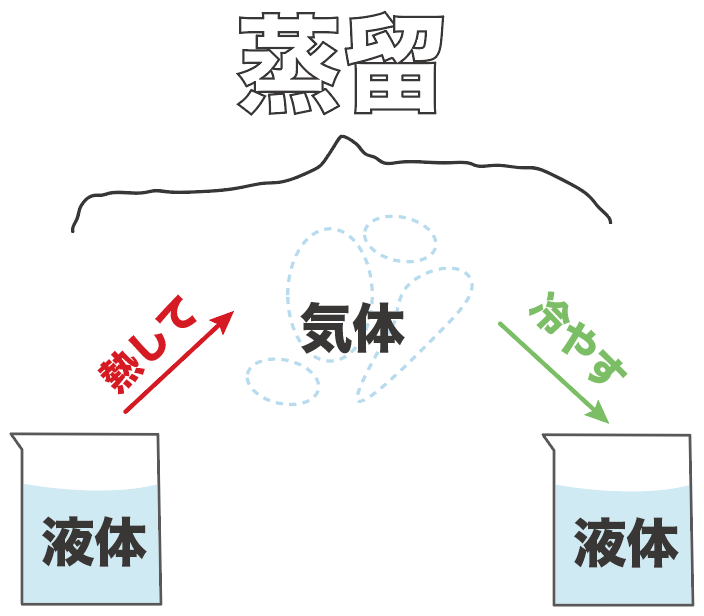
たとえば、25℃の水を蒸留で取り出すシチュエーションを想像してみてくれ。
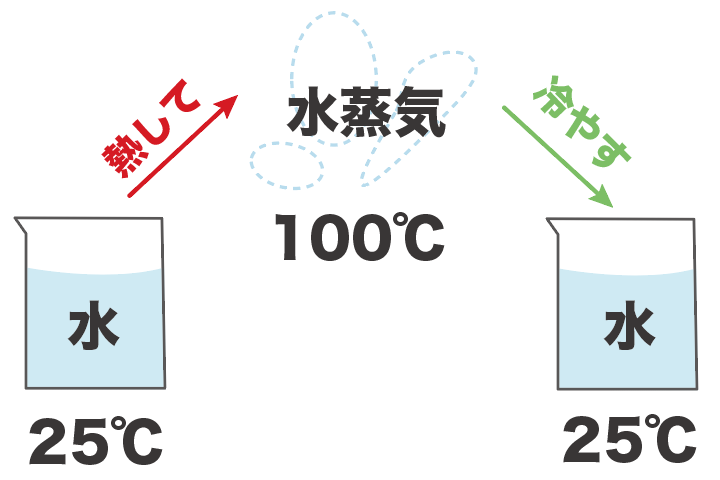
まず、水を熱して、100度まで持っていく。
すると、水が水蒸気になるから、この水蒸気を取りこぼさないように確保。
この水蒸気をもう一回冷やすことで、水に戻して、水自体をゲットするわけだ。
これが蒸留ね。
ただ、蒸留の真価が問われるのは、
色々混ざっている液体から、ある特定の液体を取り出したいとき
だ。
たとえば、
の4つの物質が混じっている液体があったとしよう。
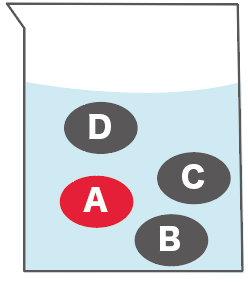
この液体からきれいさっぱりAだけ取り出したいときがあるよね。そんな時は蒸留を使って取り出すと便利。
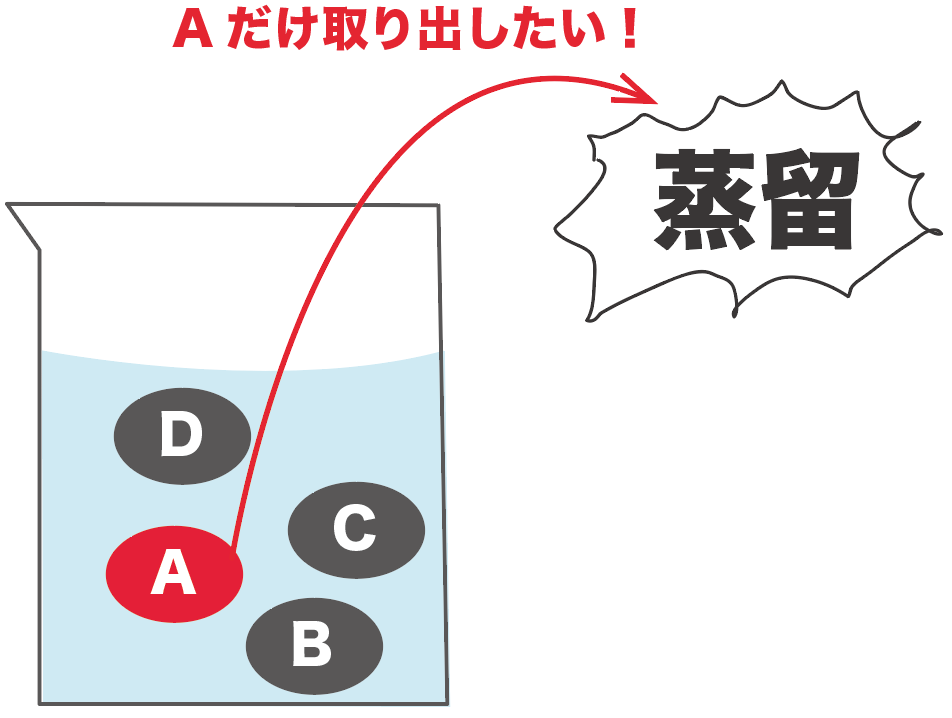
蒸留は物質の種類によって沸点が異なることを利用していくよ。
とりえあず、いろいろ混じっている液体を熱してみる。
すると、沸点が低い物質は、他の物質よりも先に気体になるよね??
ってことは、その時点で気体になっているのはこの沸点の低い物質だけだ。
この気体を冷やして液体にしてみると、純度100%の液体が取り出せるわけね。
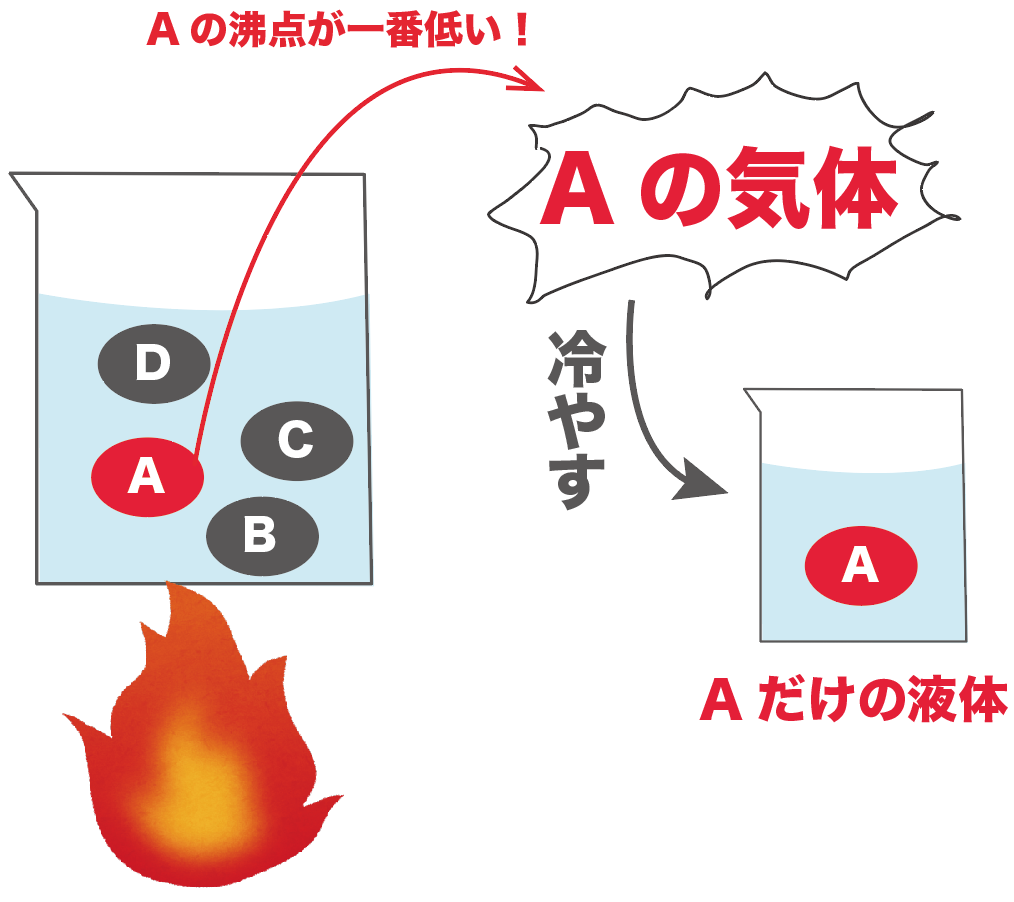
たとえば、水とエタノールが混じった液体があるとしよう。
こいつを熱してあげると、どうなる??
エタノールの方が水よりも沸点が低いから、まずはエタノールの方が気体になっていくんだ。
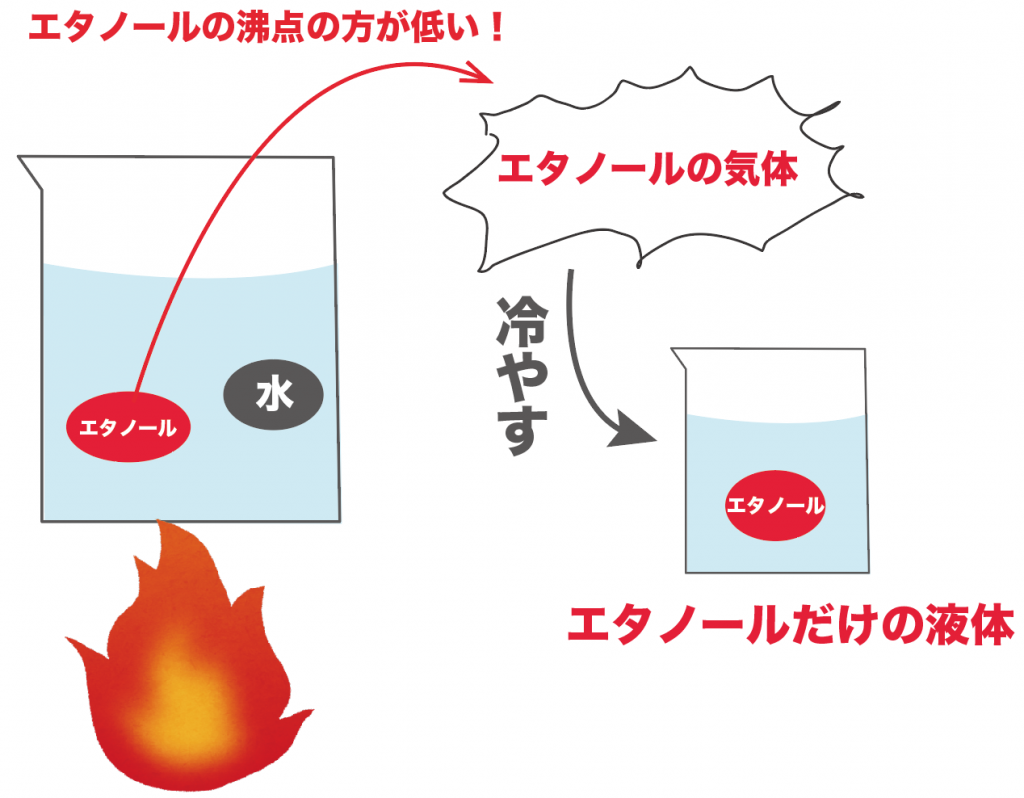
この出てきた気体を冷やすと、水が混ざっていないエタノールを100%の純度で取り出せるわけだ。
以上が蒸留だったね。
最後に復習しておこう。
蒸留とは、
ある液体の物質を熱して気体にして、冷やして液体に戻して取り出す方法だ。

なぜ蒸留を行うかというと、
沸点の異なる物質が混ざった混合物から、特定の物質を取り出すためなんだ。

蒸留はテストにでやすいからよーく復習しておこう。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。チキンスープの匂いがするね。
中学1年生の理科では、
っていう2つのちょっと紛らわしい理科の用語を勉強していくよ。
「沸点」と「融点」はともに、
ある物質が状態変化する温度のことなんだ。
今日はテストでもごっちゃ混ぜにして間違えないように、沸点と融点の違いをわかりやすく解説してみたよ。
よかったら参考にしてみてね。
それじゃあ早速、沸点と融点の違いをみていこう。
沸点とはズバリ、
液体が気体に変化するときの温度のこと
だよ。
たとえば、25℃の液体の水を熱し続けて、100℃にしたとき、水が水蒸気に変化し始めたとしよう。
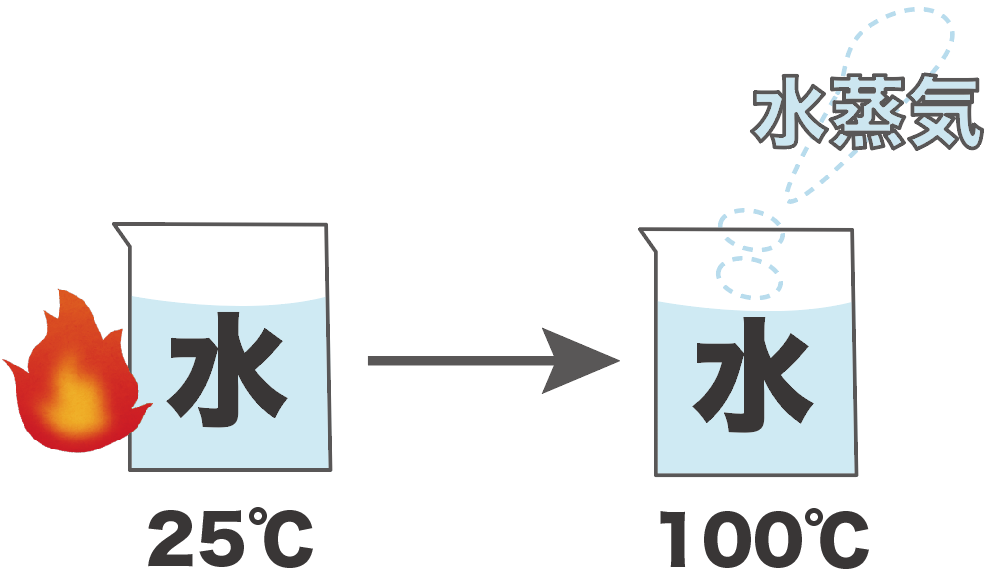
このとき、この水の沸点は100度だ。
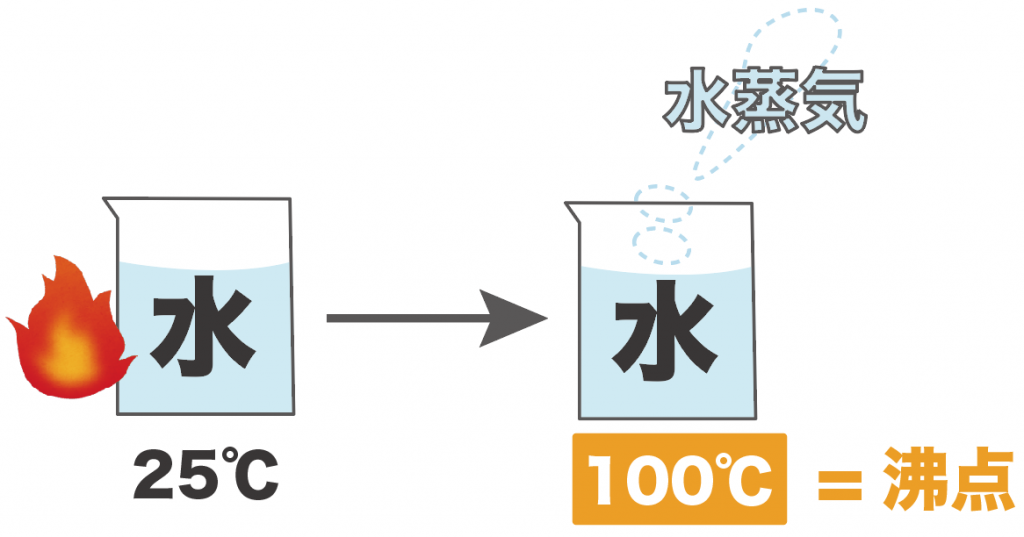
なぜなら、液体の水が100度で水蒸気という気体に変化したからね。
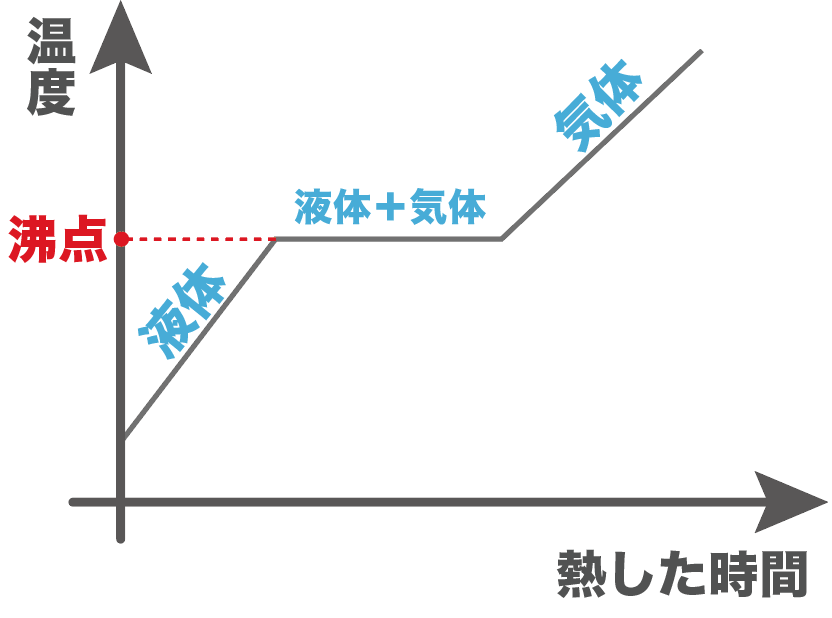
縦軸を温度、横軸を熱した時間のグラフをかいてあげると、次の温度が沸点になるはずだ。
続いて、融点。
融点とは、
固体が溶けて液体に変化するときの温度のこと
だ。沸点は液体から気体への変化する温度だったけど、今度は固体から液体ってわけ。
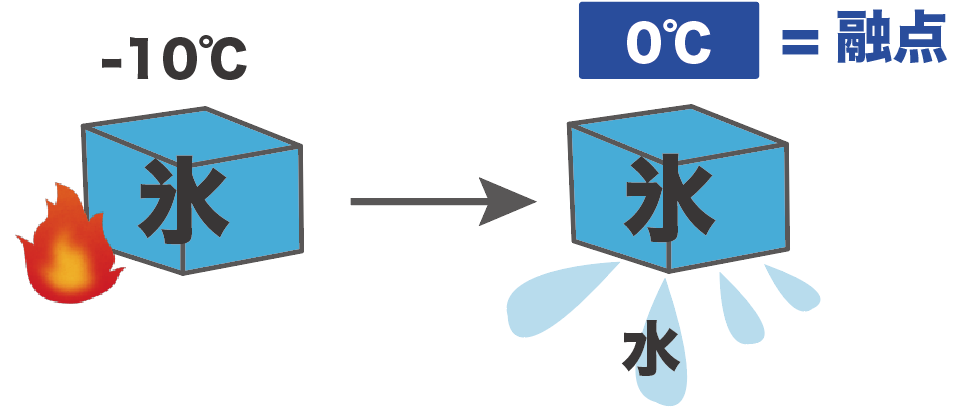
たとえば、-10℃の固体の氷をあっためていたら、0℃で溶け出して水に変化し始めたとしよう。
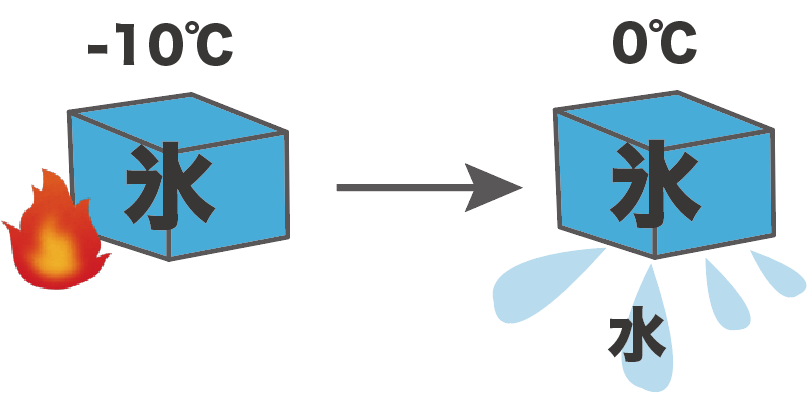
このとき、水の融点は0度。
なぜなら、氷(固体)が水(液体)に変化した温度だからね。
温度と熱した時間のグラフをかくと、次の温度が融点ってことになるね。
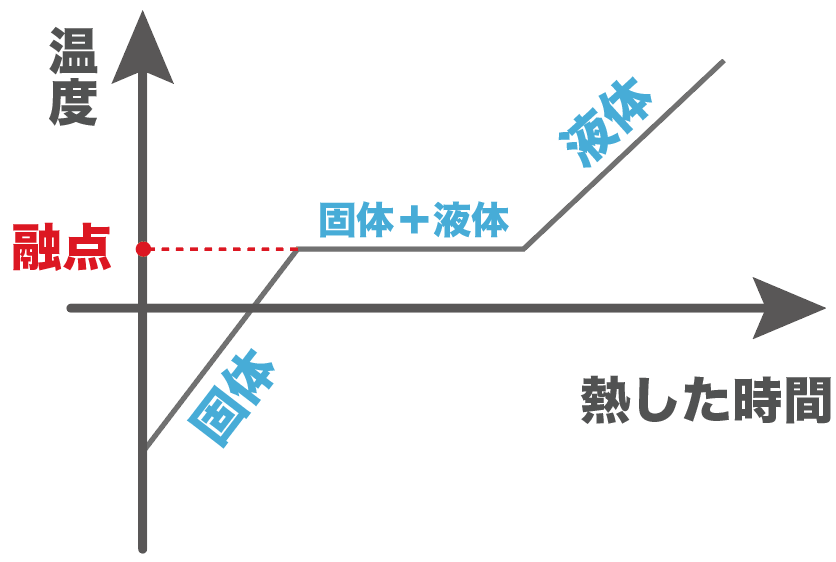
ここまでが沸点と融点の基礎だったね。
あと、1つ知っておいた方がいいのが、
沸点と融点は物質によって異なる
ってことだ。
物質の量は関係なく、純粋に何が状態変化するのかで決まってくるんだ。
たとえば、下の表は、各物質の沸点と融点を記載している表だよ。
| 物質名 | 融点 [℃] | 沸点 [℃] |
|---|---|---|
| 鉄 | 1535 | 2750 |
| 金 | 1064 | 2807 |
| 水 | 0 | 100 |
| エタノール | -115 | 78 |
| 窒素 | -210 | -196 |
物質によってここまで沸点と融点が違うとはね・・・!
鉄や金の沸点は半端ないぜ。
以上が沸点と融点の違いだったよ。
もう一度復習すると、沸点と融点は両方とも「物質の状態が変化する温度」のことなんだけど、
沸点と融点では、状態変化のフェーズが違うんだ。
沸点とは「液体」が「気体」になるときの温度で、

融点とは、固体が液体になるときの温度だ。

2つの用語は紛らわしいから、テスト前によーく復習して間違えないようにしよう。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。セコム、入ってるね。
中学1年生の理科では、状態変化を習ったよね。
状態変化とは復習すると、
物質が固体、液体、気体の3つの状態に変化すること
だったね。
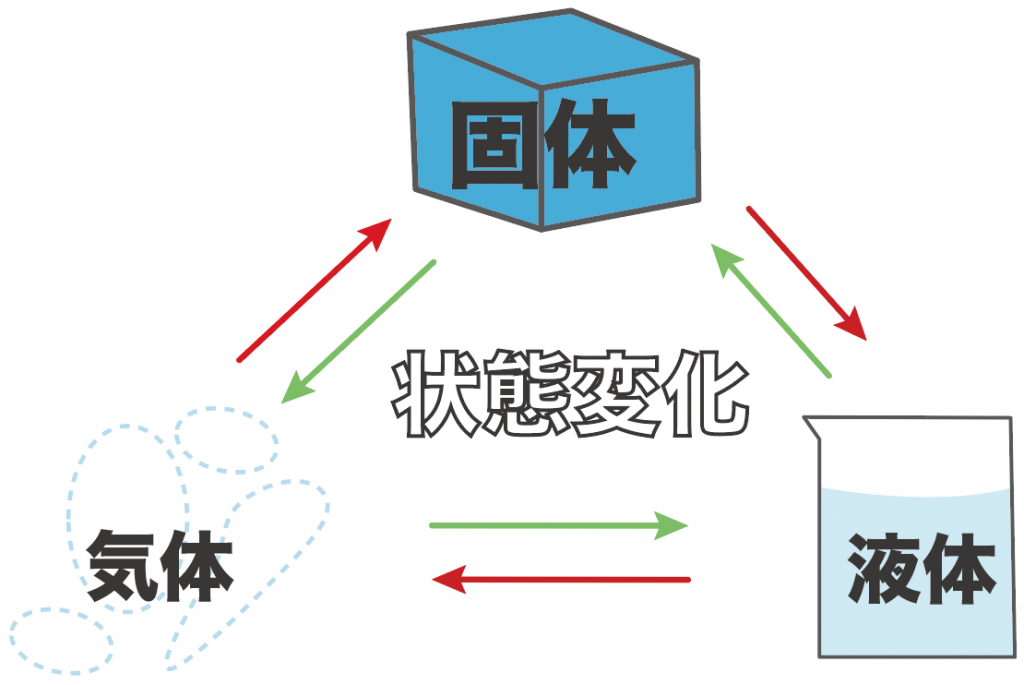
水の状態変化の場合は、それぞれ、
| 状態 | 名前 |
|---|---|
| 固体 | 氷 |
| 液体 | 水 |
| 気体 | 水蒸気 |
になるってことね。
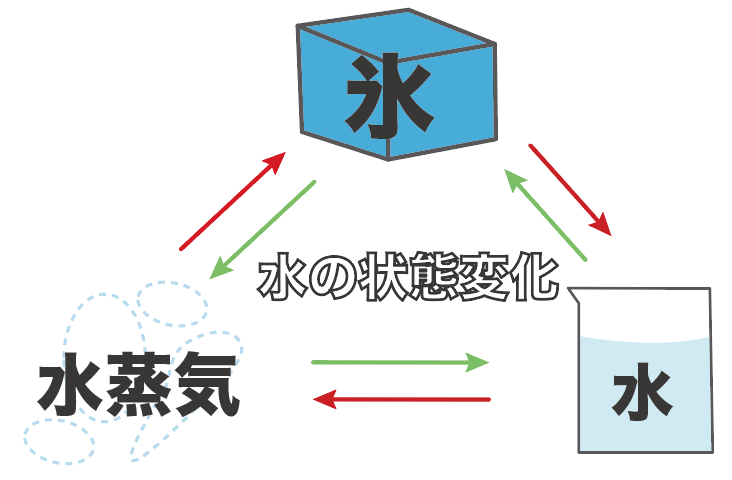
氷とか水とか水蒸気は日頃から目にしているから身近だよね。
一見、水の状態変化は他の物質の状態変化と変わらなく見えるんだけど、たった1つのポイントでとんでもなく異なっているんだ。
それは、
状態変化したときの体積の変化だ!
水の状態変化ではなんと、
「体積の変化」が他の物質の状態変化とは異なるんだよ。
具体的にいうと、
液体(水)から固体(氷)になるとき、体積が増えるんだ。
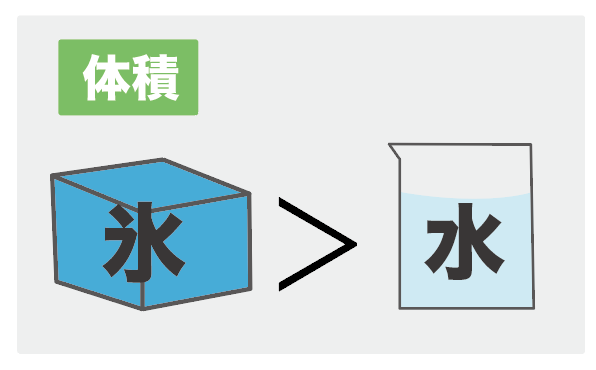
状態変化で勉強したように、他の物質では、液体から固体に変化すると、体積が小さくなることで知られているね。
粒子モデルで考えるとわかりやすいんだけど、熱が少ない固体の状態だと、粒子の動きが小さくなってしまうから、物質の体積が小さくなるはずなんだ。
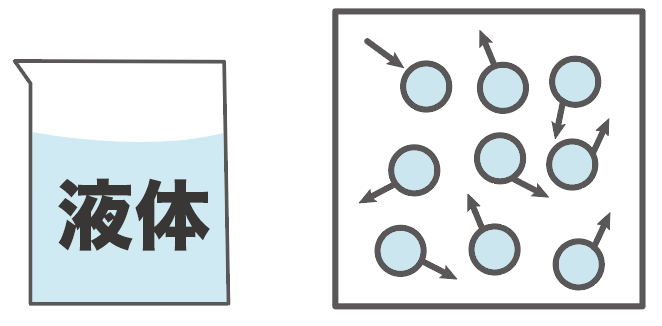
だがしかし、水の状態変化は一味違う。
液体から固体に変化すると、体積が増えてしまうんだ!!
水にはこの性質があるから、ペットボトルに水を満タンに入れて凍らせて固体にするとまあ大変。
水の時よりも体積が増えているから、ペットボトルがパンパンに膨らんでしまうはずなんだ。
じゃあ、なんで水の状態変化では固体の体積の方が液体よりも大きいんだろうね??
中学1年生の理科の範囲だと難しすぎるんだけど、簡単にいうと、
水を構成している粒子(分子)の構造によるからなんだ。
水の粒子は液体の時に、それぞれの隙間が小さくなるよに動くんだ。
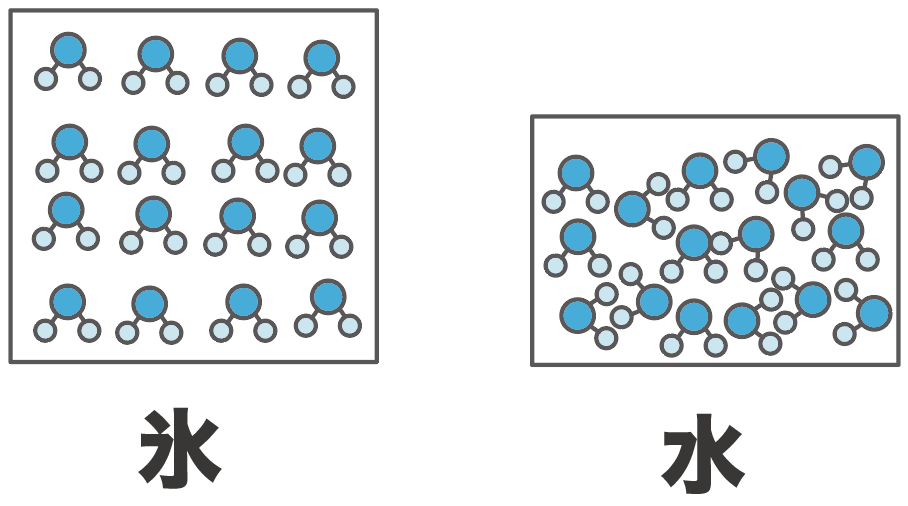
だから、水の場合は粒子の動きは活発になっているけど、粒子同士の隙間が少なくなって、体積が小さくなるんだ。
一方、氷の場合はどうだろう。
粒子たちの動きは活発じゃないんだけど、水の分子が止まって並ぶと隙間が空いているところがいっぱいあるように並んじゃう。結果的に水の時よりも体積が増えてしまうんだ。
っていう感じで、水の状態変化で気をつける点はただ一つ。
固体の方が液体よりも体積が大きいってこと。

つまり、密度でいうと、固体の氷の方が小さくなるってことね。
他の物質の状態変化とこの点で異なるから気をつけてようぜ!
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。散歩で鍛えてるね。
中1理科の身のまわりの物質という単元では、
状態変化
という言葉を勉強していくよね??
状態変化とは一言でいうと、
ある物質が温度によって固体・液体・気体の状態に変化すること
なんだ。

んで、じつは、それぞれのフェーズに行く時のプロセスには次のようにそれぞれ名前がついているんだ。
| 状態変化 | 呼び名 |
|---|---|
| 固体から液体 | 融解(ゆうかい) |
| 液体から固体 | 凝固(ぎょうこ) |
| 液体から気体 | 蒸発(じょうはつ) |
| 気体から液体 | 凝縮(ぎょうしゅく) |
| 気体から固体 | 昇華(しょうか) |
| 固体から気体 | 昇華(しょうか) |
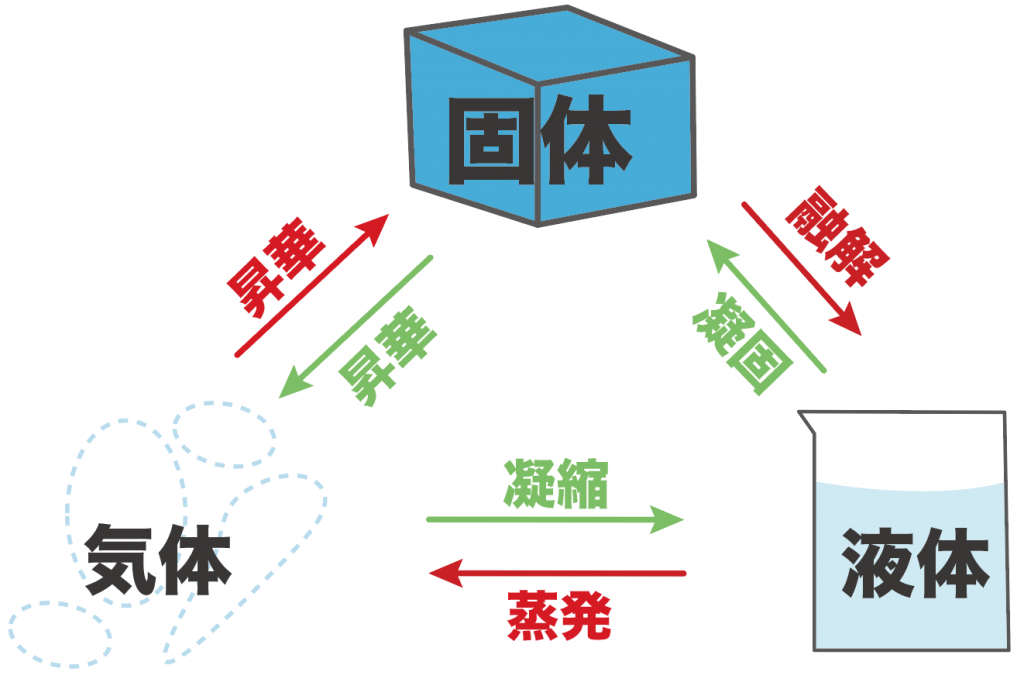
これが状態変化の基本だ。
状態変化の正体はだいたいわかってきたね。
あと、状態変化について覚えておきたいことは、
何が変化して、何が変わらないのか??
ということだ。
じつは状態変化では、
体積は変化するけど、質量は変化しないんだ。
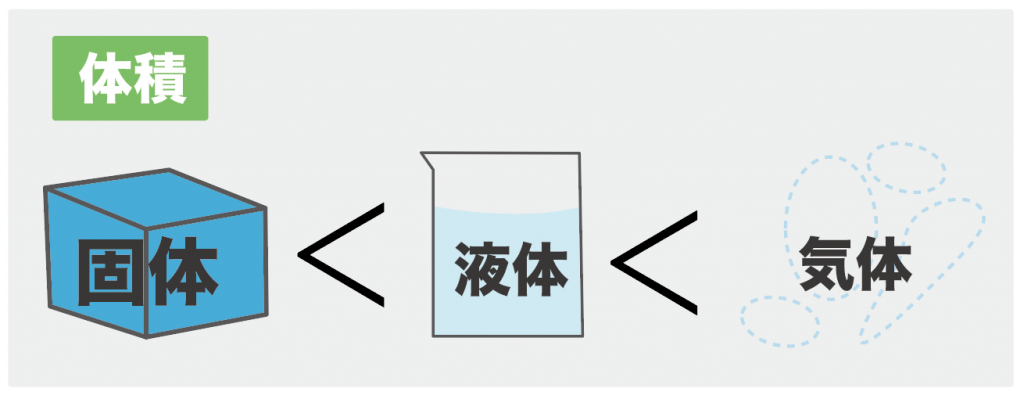
たいていの物質の場合、
固体の体積が一番小さくて、その次に液体の体積、一番気体の体積が大きい
ってことになってるんだ。
※水の状態変化は例外だけどね
不等号で表すと、こんな感じになる↓
固体の体積<液体の体積<気体の体積

なぜ、こんな風に状態変化によって体積が異なるんだろう??
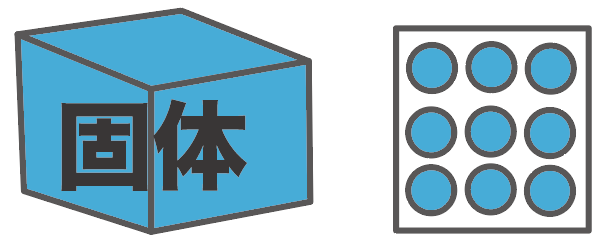
それは、粒子のモデルで考えるとわかりやすくなるよ。ある物質がたくさんの粒子の塊でできていると仮定して考える方法さ。
この粒子たちには、
熱を加えると、動きが活発になる
っていう性質があるんだ。
だから、一番温度が低い固体の時は、粒子たちは全然活発じゃないから、縮こまっているはず。

温度が上がって粒子の動きが活発になってくると、粒子たちの活動範囲が大きくなるよね??
ゆえに、粒子が活発になって液体になった時には、物質全体の体積は大きくなってるわけだ。

さらに、温度を上げて気体にすると、もうすごい。
粒子が活発になって縦横無尽に動き回る回る。
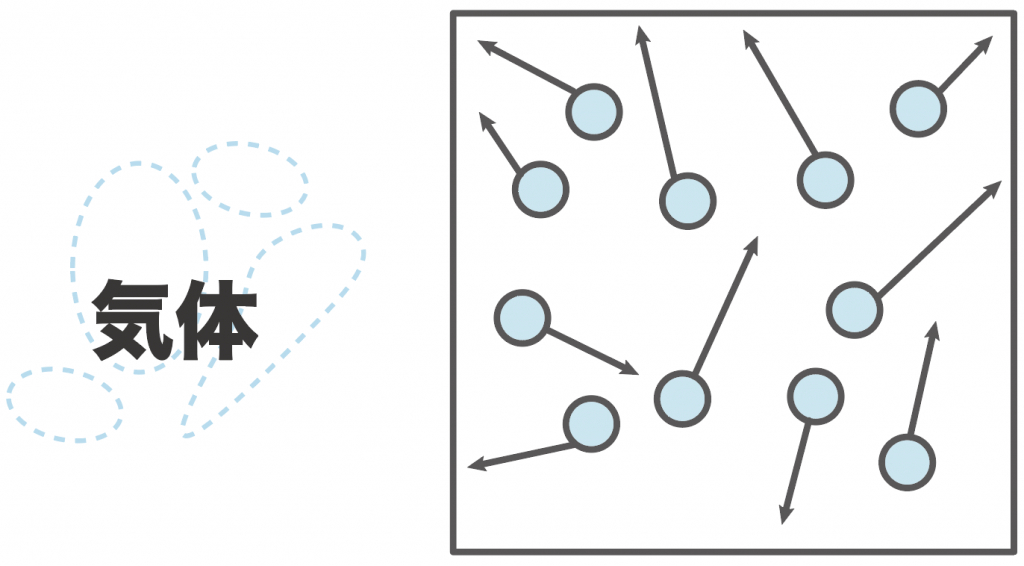
粒子たちが動き回る範囲が広がってるから、気体の体積は広がってると言えるんだ。
以上が状態変化だね。最後に復習しておこう。
状態変化とは、
ある物質が温度によって固体・液体・気体の状態に変化すること
で、それぞれのフェーズに移るプロセスには名前がしっかりついていて、

状態変化によって体積は変化するけど、質量は変化しない。

んで、たいてい、
固体の体積<液体の体積<気体の体積
になってるよ。ただ、水の状態変化は例外だけどね!
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。座りながら鍛えてるね。
中1理科の身のまわりの物質では、
再結晶
っていう用語を勉強していくよね。
日常で使わない言葉だから難しそうに聞こえる。。
だけどね、この前勉強した「溶解度曲線」を使えばなんとかしっくりくるもんなんだ。
今日は、溶解度曲線を使って再結晶とは何かを振り返っていこう。
まず「再結晶」をウィキペディアで調べてみよう。
合成または抽出などによって得られた粗結晶(純度の低い結晶)をより良質で不純物の少ない結晶へと成長させるための操作である
って書いてあるね。
難しそうな言葉がたくさん使われていて、正直よくわからない。
要はここでは、
不純物が混じっている物質を、ある動作(合成または抽出)によって、純粋にそれしか混じっていない良質な結晶を作ること
といっているね。
たとえば、物質AとBの混合物があったとして、ある動作をすることで、こいつから物質Aだけ取り出すことなわけだ。
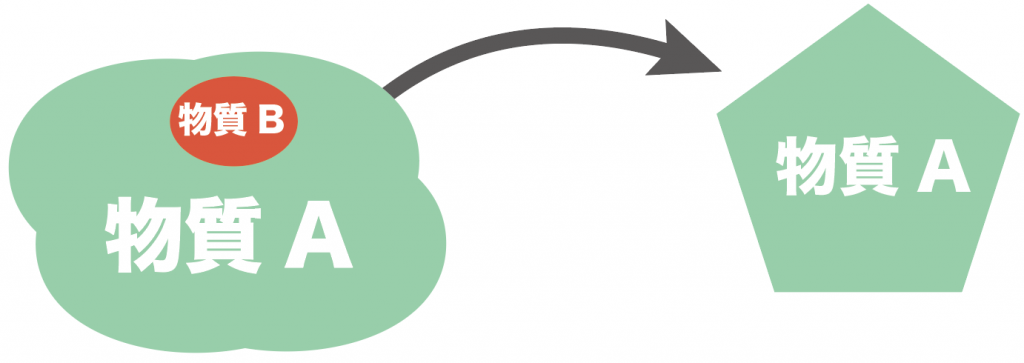
特に中学校で勉強する理科では、「溶解度の差」を利用して、純度の高い結晶を取り出していくよ。
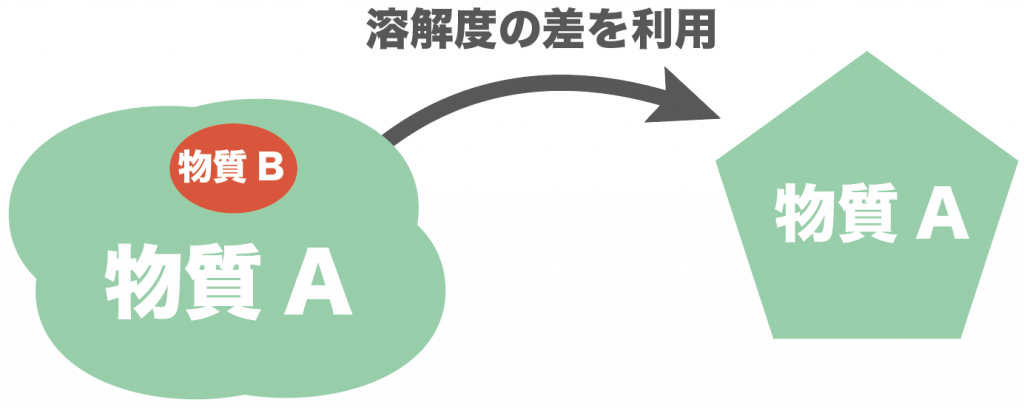
今日は、この溶解度の違いを利用した再結晶の方法をわかりやすく解説してみよう。
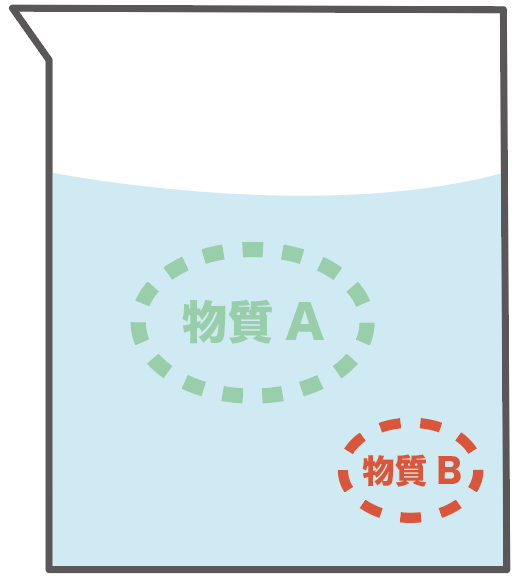
まず、Bが混じっちゃってる物質Aを想像してみて。

本当は物質Aだけが欲しいのに、どういうわけか、物質Bが不純物として混じってしまったんだ。
そこで君のボスは、
「不純物Bが入ってない物質Aだけの結晶が欲しい」
と言ってくる。

こういうときは、物質Aと物質Bの溶解度曲線の違いを利用して再結晶をしてみよう。
まず、不純物Bが混じった物質Aを水にとかしてみるんだ。
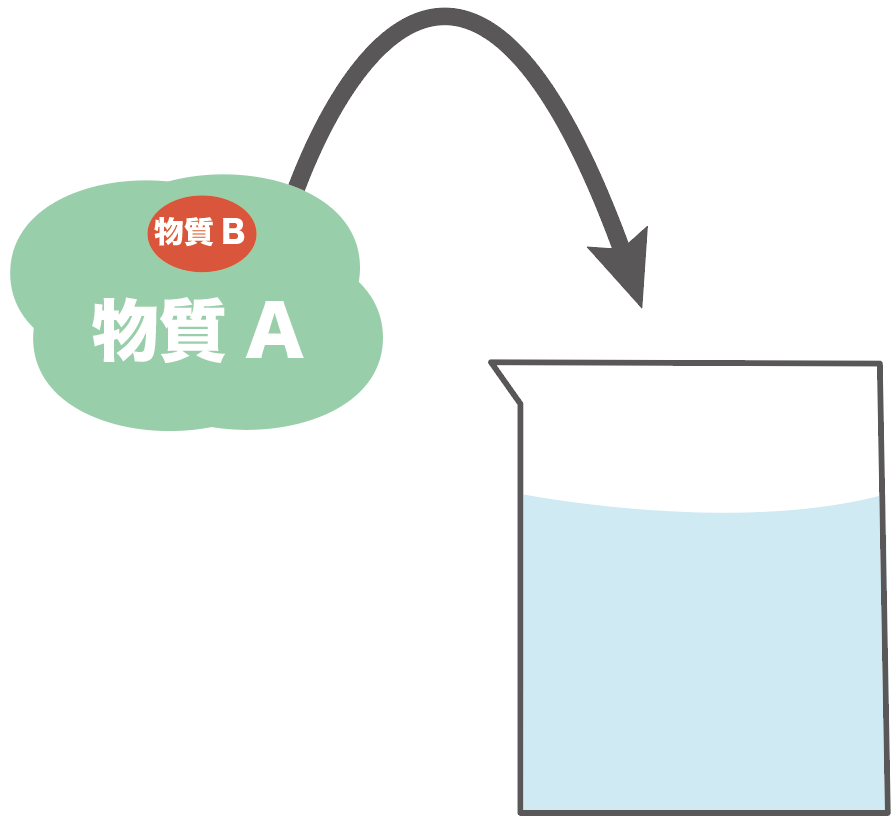
溶けて見えなくなるまでかき混ぜてみよう。
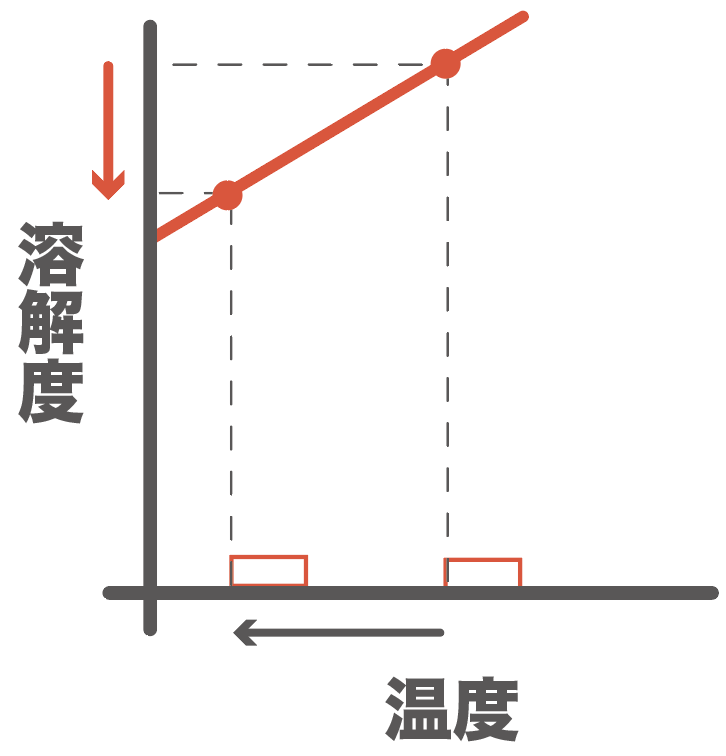
物質Aと物質Bが入り混じった水溶液を冷やしてみよう。
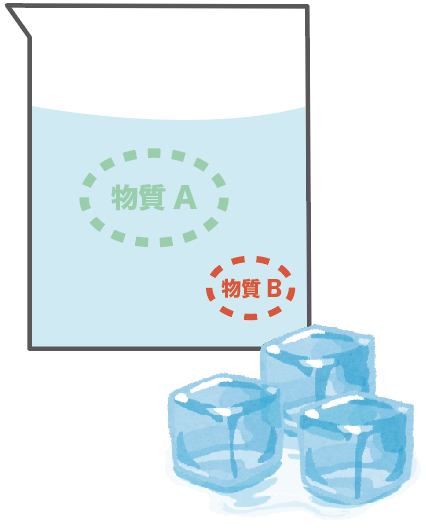
冷やすと何が起こるかっていうと、
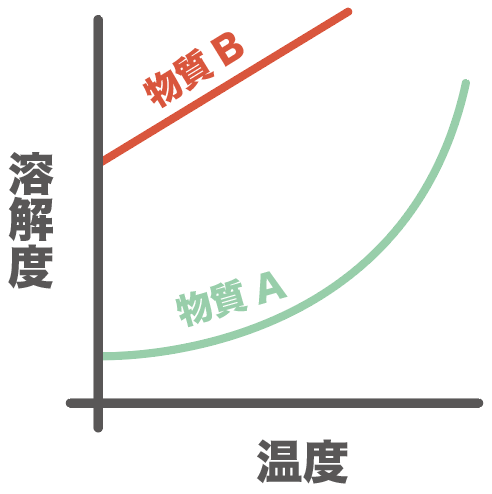
それぞれの物質の溶解度が変化するんだ。
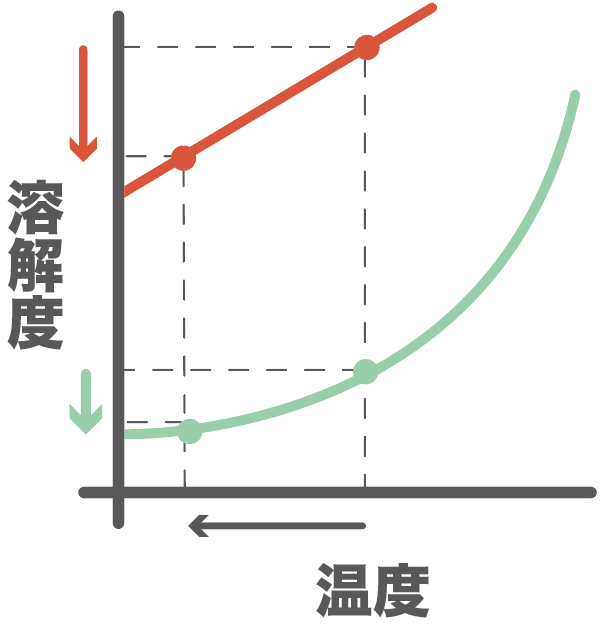
すると、さっきまで溶けていた物質Aの一部が、溶解度が小さくなったから、溶けきれなっちゃう。
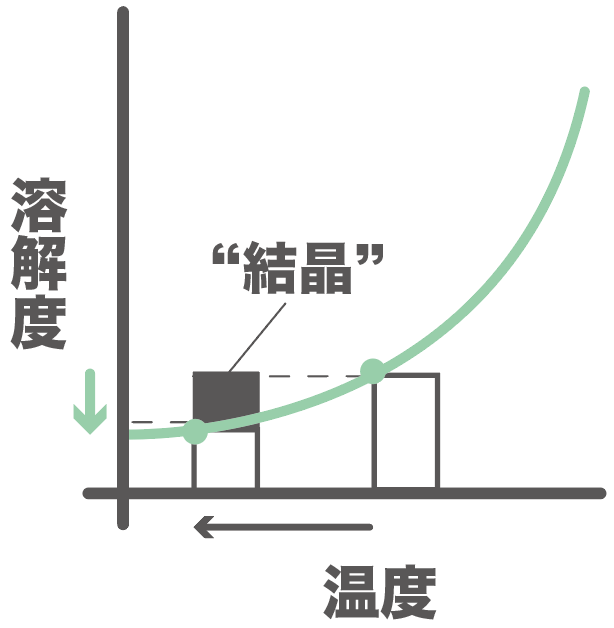
溶けきれなくなった分は、結晶として出てくるよ。
物質Bは少ししか含まれてなかったし、物質Aより溶解度が大きいから、冷やしてもまだ水に溶けられていたんだ。
物質Aは十分すぎるほど水に溶けていて、溶解度より超えちゃった分があったんだ。
それが固体の結晶として出てくる。
物質Bはまだ溶解度が変化しても水に溶けていられたね?
だから、今回、結晶として得られたのは、
物質Aのみ、
だ。

こうして、物質Aと物質Bの混合物を水溶液に溶かして冷やすことで、結晶として純粋な物質Aだけを取り出せるわけね。
この一連の操作のことを、
再結晶
と呼んでいるんだね。
うん、しっくりしたぜ。
以上が再結晶のおおまかな流れね。
最後にもう一度復習しておこう。
物質Aに、不純物の物質Bが混じっちゃってて、

なんとか物質Aだけを取り出したいとき、再結晶を使うよ。
まず、混じった物質たちを水に溶かして、冷やして、溶解度を小さくすると、溶けきれなくなった物質Aが結晶で出てくる。

物質Bはちょっとしか含まれてなかったし、物質の性質上、温度が下がってもまだ十分な溶解度を持つことができたらしい。

ゆえに、冷やすと、溶けきれなくなった、物質A(純粋)が結晶として取り出せたんだね。

再結晶は狙われやすいからテスト前によーく復習しておこう。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。チキン、摂取したね。
中1理科のテストで狙わられやすいのが、
溶解度曲線の問題
だ。
たとえば、次のような問題だね。
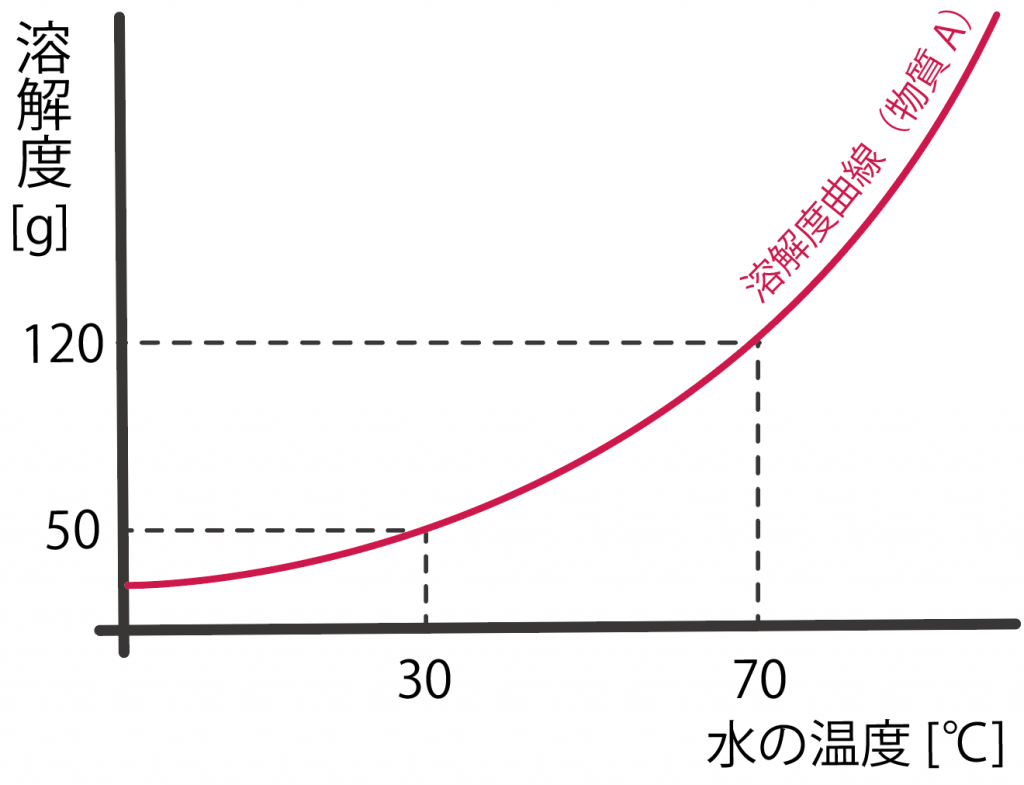
物質Aを70℃の水100gにとかして、物質Aの飽和水溶液を作った。この飽和水溶液を30℃まで冷却した時、物質Aは何g結晶としてでてくるか計算しなさい。
今日はこんなタイプの、溶解度曲線に関する問題の解き方をわかりやすく解説していくよ。
よかったら参考にしてみて。
溶解度曲線の問題の解き方は、つぎの3ステップで攻略できるよ。
さっきの練習問題を一緒に解いていこうか。
物質Aを70℃の水100gにとかして、物質Aの飽和水溶液を作った。この飽和水溶液を30℃まで冷却した時、物質Aは何g結晶としてでてくるか計算しなさい。

まずは、飽和水溶液に含まれている物質の質量をゲットしよう。
溶解度曲線から読み取ればいいのさ。
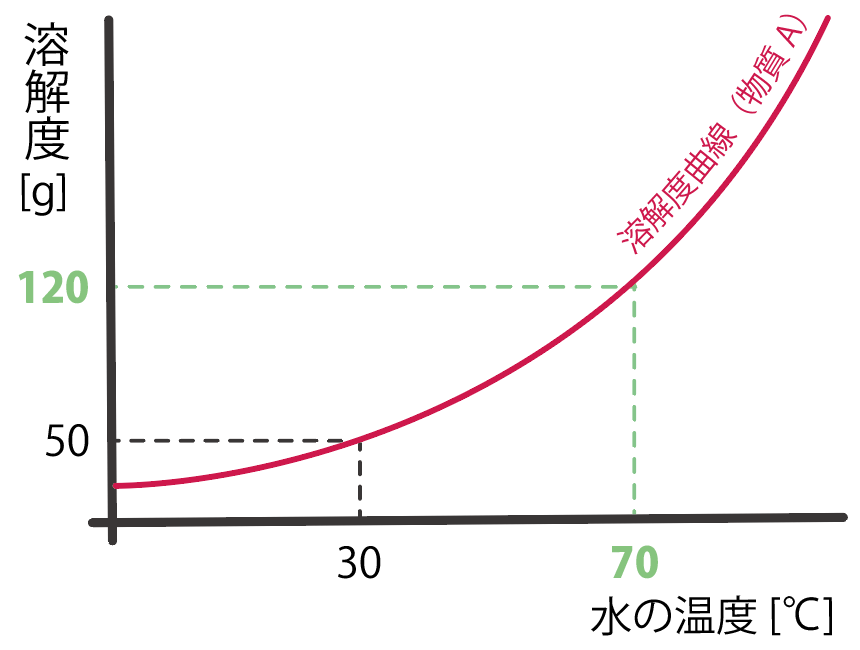
物質Aの溶解度曲線を見てみると、温度70℃の時の溶解度は、
120[g]
であることがわかるね。
溶解度とは、
水100gの時作った飽和水溶液に溶ける物質の質量
だったね??
ってことは、100gの水にはその溶解度分溶けることになるから、
120[g]
の物質Aが潜んでいたということになるね。
続いては、温度が変わったときの溶解度をゲットしよう。
ここでもやはり、溶解度曲線が大活躍さ。
練習問題では、
飽和水溶液の温度は30℃に冷やされる
んだったよね??
ってことは、物質Aの溶解度曲線から温度30℃のときの溶解度を読み取ればいいのさ。
つまりここでは、
温度が変わったときに、どれくらい水が物質を溶けさせられるか??ってことを読み取るんだ。
練習問題の溶解度曲線を見てみると、温度30℃のときの溶解度は、
50[g]
らしい。
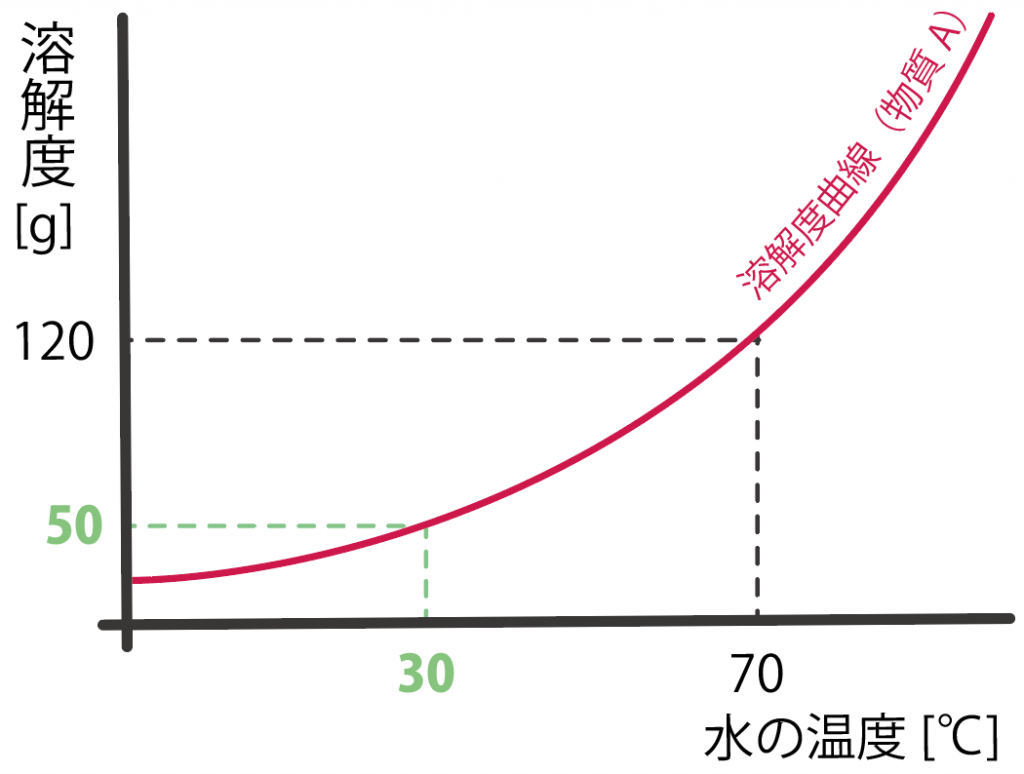
んで、この溶解度は水100gに対するものだったから、温度が変わった後は、
50 [g]
まで物質Aが水に溶けることができそうだ。
後は引き算するだけ。
(飽和水溶液に含まれていた物質の質量)- (温度が変わった時の溶解度)
だ。
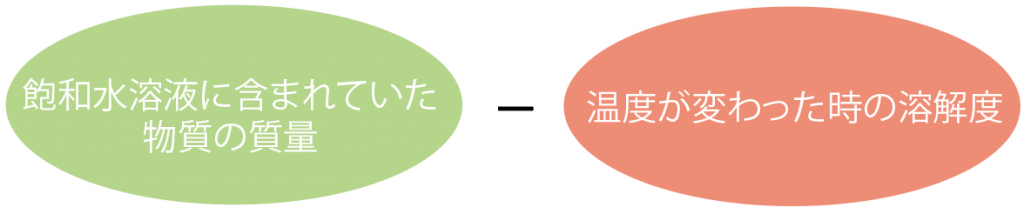
この計算では何をやっているかというと、
元々水溶液に含まれていた物質Aの質量から、温度が変わった時に水に溶けられる質量を引いてるんだ。
つまり、この引き算をすると、
温度が変わって水に溶けられなくなった物質Aの質量が出てくるわけ。
解けられなくなった物質Aが結晶として出てくるのさ。
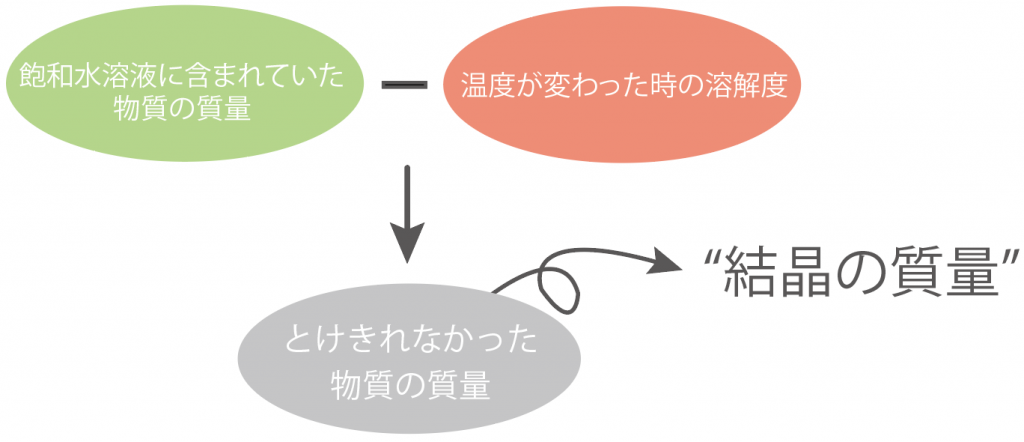
練習問題でも同じ計算をしてみよう。
さっきまでのステップで、
| 飽和水溶液に含まれていた物質の質量 | 120 [g] |
|---|---|
| 温度が変わった時の溶解度 | 50 [g] |
ってことがわかっていたよね。
だから、
(飽和水溶液に含まれていた物質の質量)- (温度が変わった時の溶解度)
= 120 – 50
= 70 [g]
になる。
つまり、物質Aの飽和水溶液を30℃まで冷やすと、70 [g]の結晶が出てくるってわけだ。
以上が溶解度曲線の問題だったね。
解き方は次の3ステップでバッチリなはず。
ポイントはズバリ、溶解度曲線の読み方だ。
水の温度を調べて、その温度の時に、溶解度がどうなっているのか??
を読み取ればいいのさ。
テストにも出やすいからよーく復習しておこう。
「飽和水溶液、溶解度、溶解度曲線がしっくりこない・・・!」
というときは下の記事で基本を復習してみてね。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。水と、生きてるね。
中1理科の「身のまわりの物質」という単元では、
という3つを習っていくよね??
漢字ばっかりでとっつきにくいけど、これらの用語はテストによく出てくる。マスターしておくことに越したことはないね。
そこで今日は、飽和水溶液・溶解度・溶解度曲線の3つをわかりやすく解説していくよ。
今回勉強していく、
は主に、
ある物質を水に溶かすときに使う理科の用語
なんだ。
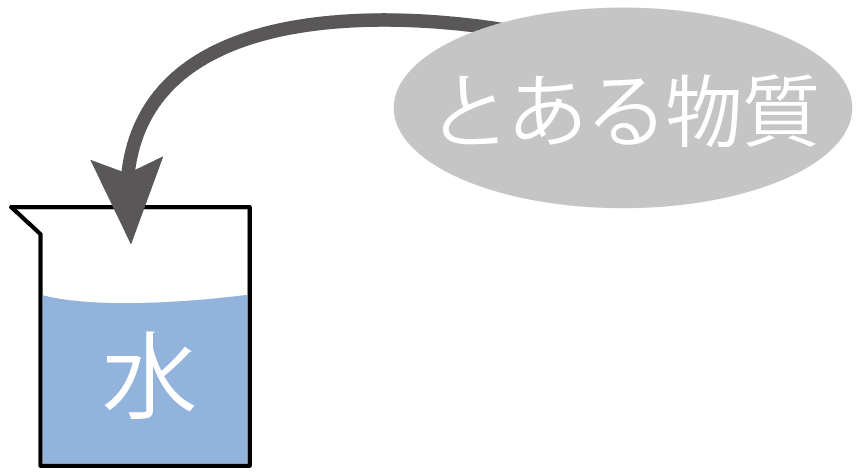
まずはこのシチュエーションを頭の中で想像してみて。
ある物質を水に溶かすとき、じつは、
水は無限にその物質を溶けさせることはできない。
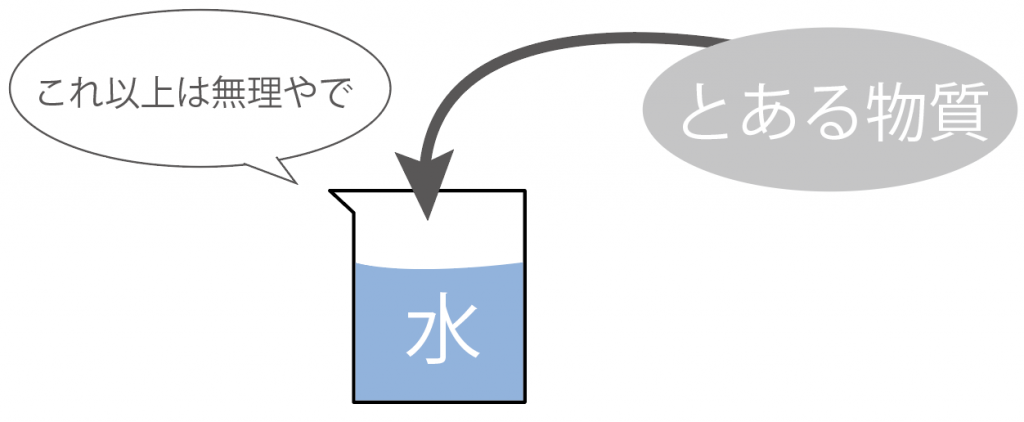
水には物質を溶けさせることができる限界ってもんがあるんだ。
んで、
ある物質が水の限界まで溶けきった水溶液のことを、
飽和水溶液
って呼んでいるのさ。
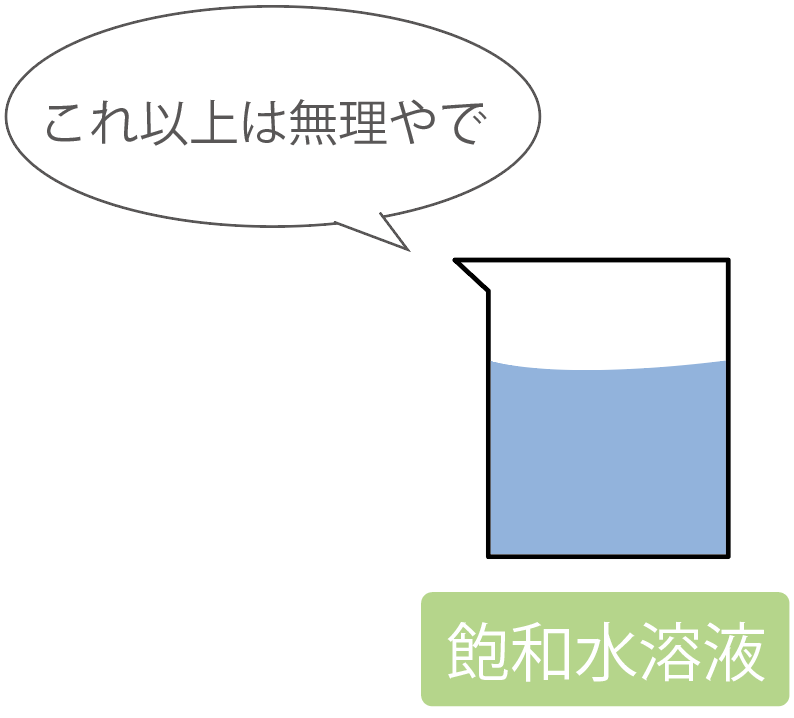
飽和水溶液にこれ以上その物質を加えてみても、その物質は溶けずに沈殿しちゃうだろうね。
飽和水溶液をつくるためにどれくらい物質を溶かしたのか?
を表したのが「溶解度」ね。
もっと具体的にいうと、
ある物質を水100gにとかして飽和水溶液にした時のとかした物質の量
のことさ。
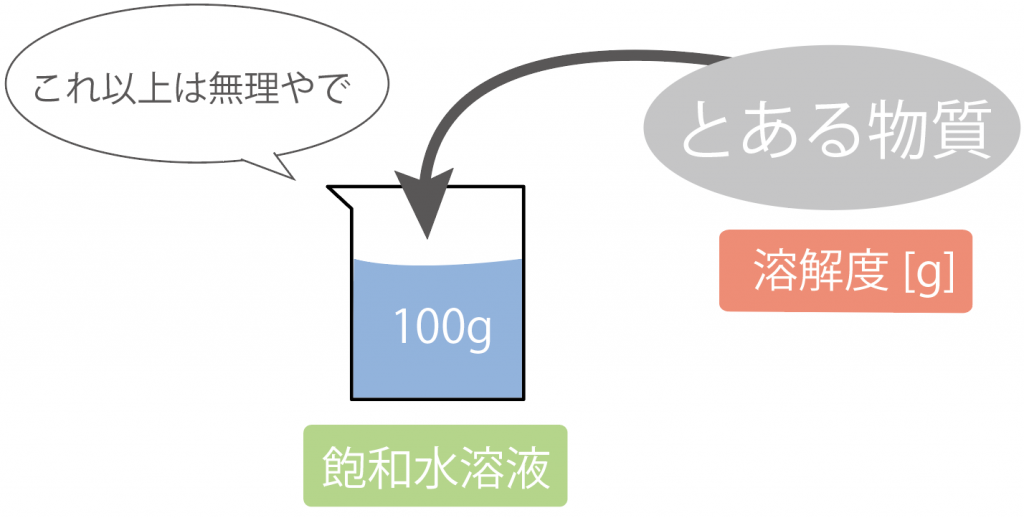
たとえば、水100gにミョウバンを混ぜまくって、ミョウバンの飽和水溶液を作ったとしよう。
このとき、ミョウバンを40g混ぜて飽和水溶液ができたとすると、このミョウバンの飽和水溶液の溶解度は40gさ。
じつは、この溶解度というものは、
温度によって変化することが知られているよ。
たとえば、20℃の時の溶解度が40gだったとしても、あぶって100℃にしたら溶解度が80gになることもあるわけだ。
この、水の温度によって溶解度が変化する様子をグラフにしたものを、
溶解度曲線(ようかいどきょくせん)
と呼んでいるよ。
この溶解度曲線というグラフは、
をとったものだね。
だいたいこんな感じ↓↓
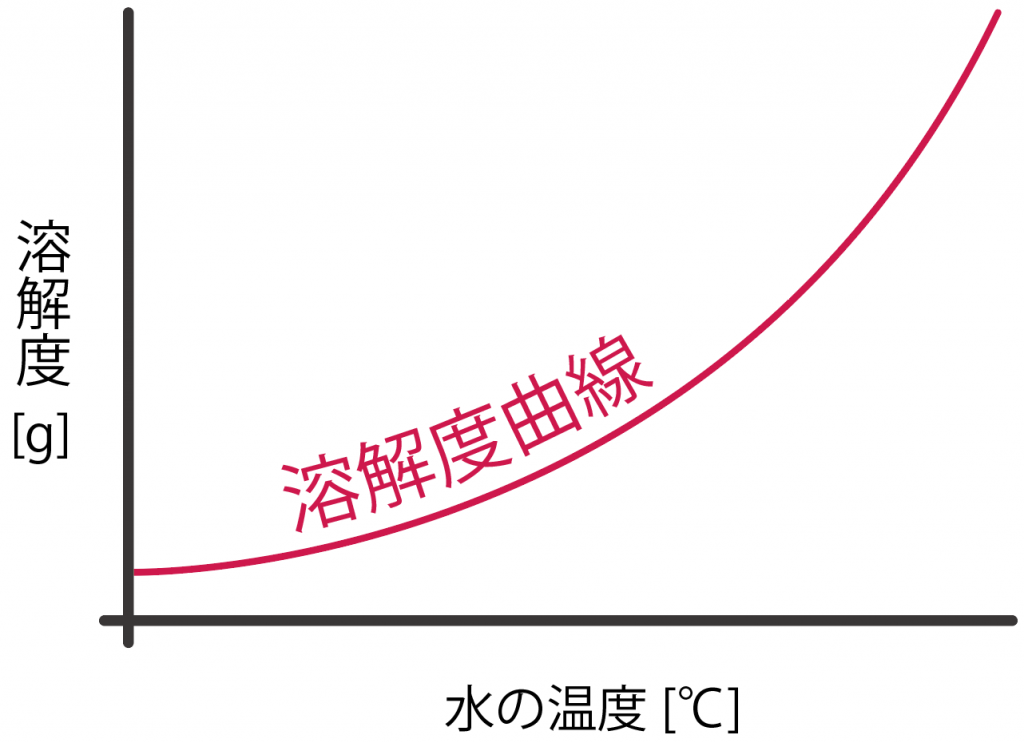
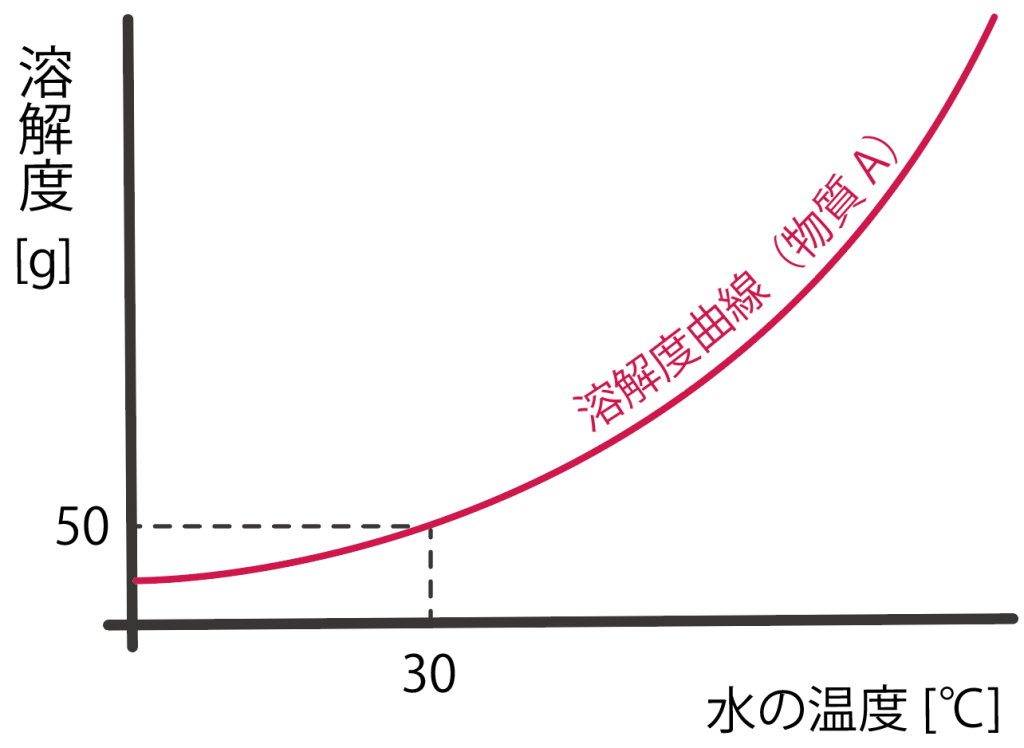
この溶解度曲線というグラフの読み取り方は簡単。
たとえば、物質Aの30℃の溶解度を知りたいときは、30℃の時の溶解度を溶解度曲線から読み取ってあげればいいんだ。
下の例だと、物質Aが30℃の時の溶解度は50gになりそうだね。
以上が飽和水溶液・溶解度・溶解度曲線だったね。
最後に復習しておこう。
っていう用語は全て、
ある物質が水に溶けるシチュエーション
で使う用語。

飽和水溶液とは、ある物質がこれ以上溶けきれないぐらい溶けきった水溶液のこと。
溶解度とは、ある物質が飽和水溶液に溶ける質量のことで、100gの水溶液に溶ける質量のこと。

溶解度曲線とは、温度ともに変化する溶解度の変化をグラフにしたものだったね。

これらの用語をマスターしたら、次は溶解度曲線の問題を解いてみよう!
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。端っこ、狙ってたね。
中1理科ではいろんな理科の用語が出てくるよね??
今日はその中でも、
という2つの言葉を勉強していこう。日常生活ではあまり登場しない理科用語だから、最初はてわかりにくいかもしれない。
今日はこいつらがごっちゃ混ぜにならないように、
純物質と混合物の違い
をわかりやすくまとめてみたよ。
早速、純物質と混合物の違いを見ていこう。
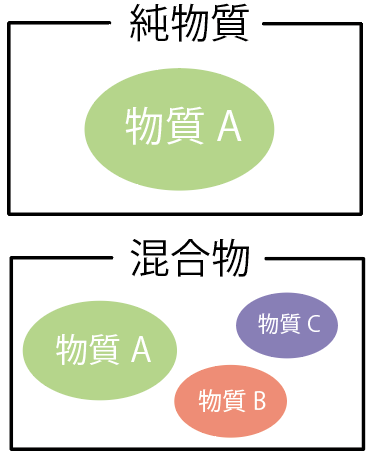
純物質と混合物の違いはズバリ、
何種類のものでできているか??
が違うんだ。
純物質は「1種類の物質」からできているものだ。

一方、混合物は「2種類以上」の物質からできているものなんだ。
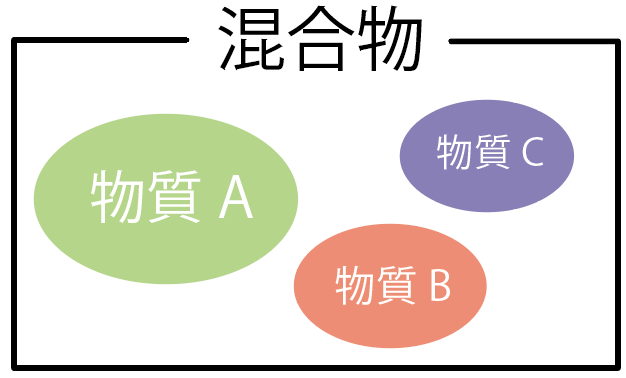
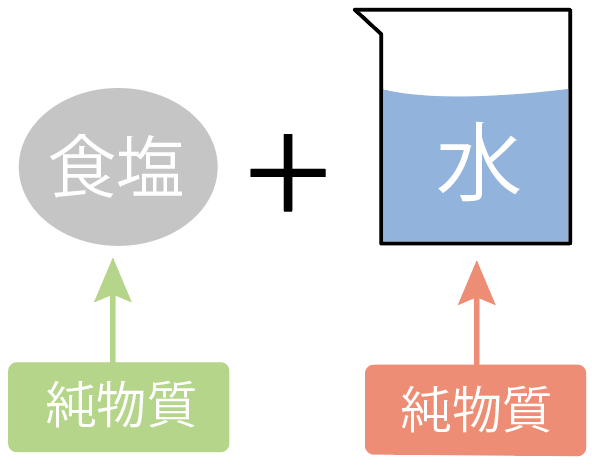
たとえば、食塩水を考えるとわかりやすいかな。
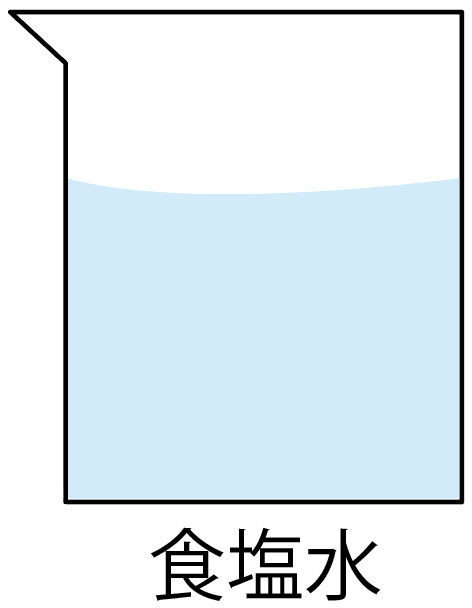
食塩水は、
の2つの物質が混じってできているよね??

ってことは、食塩水は2種類以上の物質からできているから、こいつは「混合物」だ。
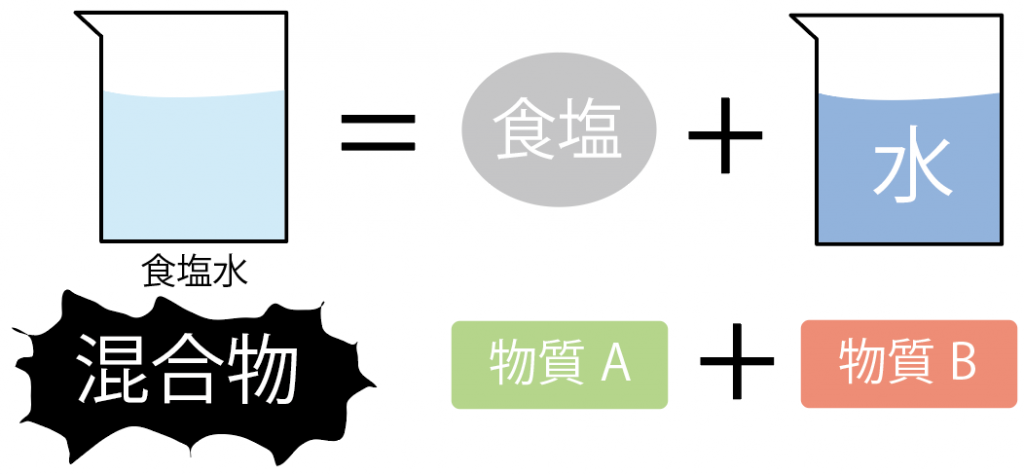
一方、この食塩水を構成している、材料の、
に注目してみよう。
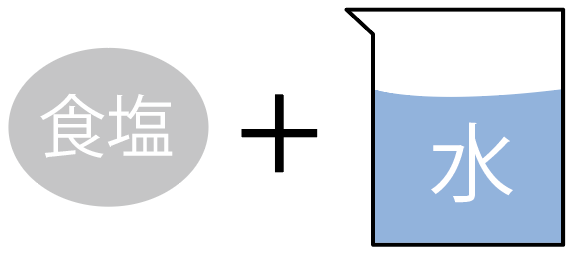
水は、「水」っていう1種類の物質からできているものだから、こいつは「純物質」。
食塩(塩化ナトリウム)も、塩化ナトリウムっていう1種類に物質からできているからこいつも「純物質」だ。
純物質と混合物の違いをマスターするために、純物質と混合物の具体例をみていこう。
古来から日本人に愛され続ける日本酒。
日本酒はアルコール、水、米、麹などを原料とするお酒だよね。
ってことは、日本酒は、
など2種類以上の物質からできていることになる。
ってことで、日本酒は混合物だ。
理科の実験でも度々登場する二酸化炭素。
こいつは二酸化炭素っていう1つの物質からできてるね。
ってことで、二酸化炭素は純物質だ。
ぼくらの周りに浮かんでいる空気。
この空気には、
などなどさまざまな物質が混じっているんだ。
2種類以上の物質からできているから、空気もまた混合物だ。
またまた理科の実験で活躍する塩酸という液体。
塩酸とは、塩化水素の水溶液のことだったね。
つまり、水に塩化水素っていう物質が溶けていることになる。
ってことは、塩酸には、
っていう2種類の物質からできてることになるね。
ってことで、塩酸も混合物だ。
以上で、純物質と混合物の違いは終了。
最後にもう一度復習しておこう。
純物質と混合物の違いは、混じっている物質の数が違くて、それぞれ、
だったね。
それぞれの具体例を確認しながら頭に刻んでいこう。
そんじゃねー
Ken
こんにちは!この記事を書いてるKenだよ。のど飴100個ぐらいほしいね。
中1理科の身のまわりの物質では、たくさんの気体の性質を見てきたよね。
覚えることがいっぱいあって、逃げ出したくなる気持ちもよくわかる。頭も痛いぜ。
だがしかし、気体の性質を調べるためには、まず、
気体を捕まえなきゃいけない。
気体を集めないことには、性質を調べたり、実験とかできないからね。
そこで今日は、そんな気体の勉強の基本中の基本ともいえる、
気体の集め方・作り方
を詳しく図を使ってみていこう。
中学の理科では、次の3つの気体の集め方を勉強していくね。
この3つの気体の集め方は正直、名前も似てるし、覚えづらい。
そこで、この気体の集め方の種類の分類と、こいつらを使い分ける方法を見ていこう。
中学理科で勉強する気体の集め方は、次の2点の観点で分類していくと覚えやすいよ。
気体の集め方で重要なのは、
「何」と気体を置き換えて集めていくか?
ってことだ。
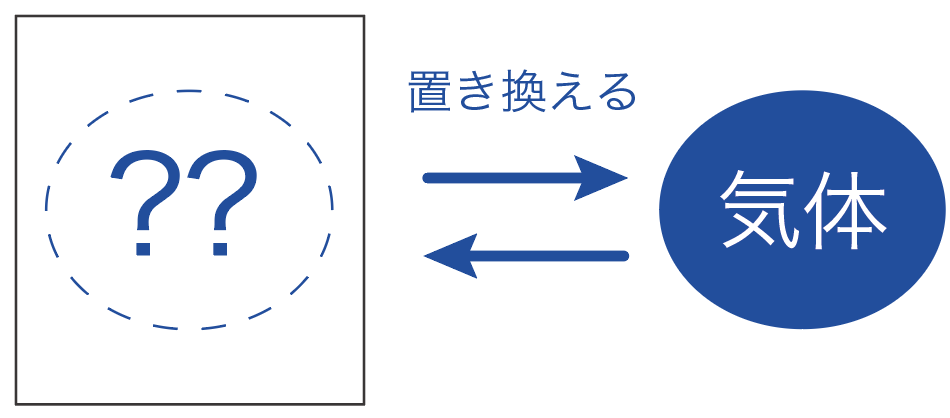
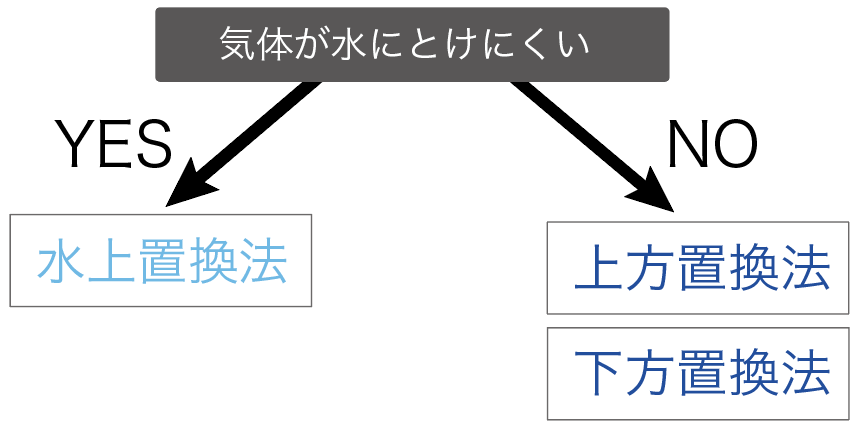
気体の集め方では、
の2通りの集め方に分けることができるんだよ。
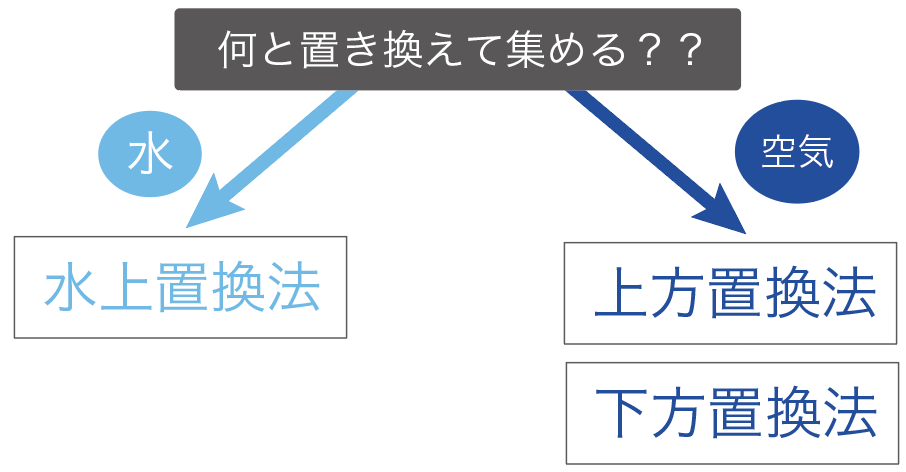
まず、「水」と気体を置き換えて、気体を集めていく方法だ。
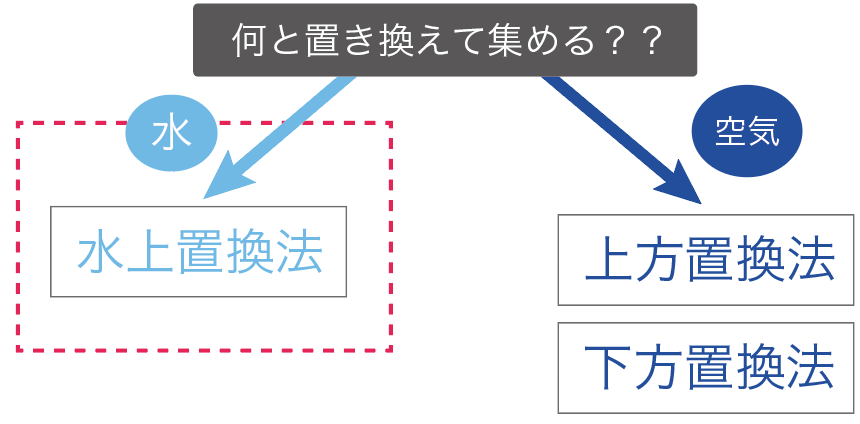
水と置き換える気体の集め方は1つしかない。
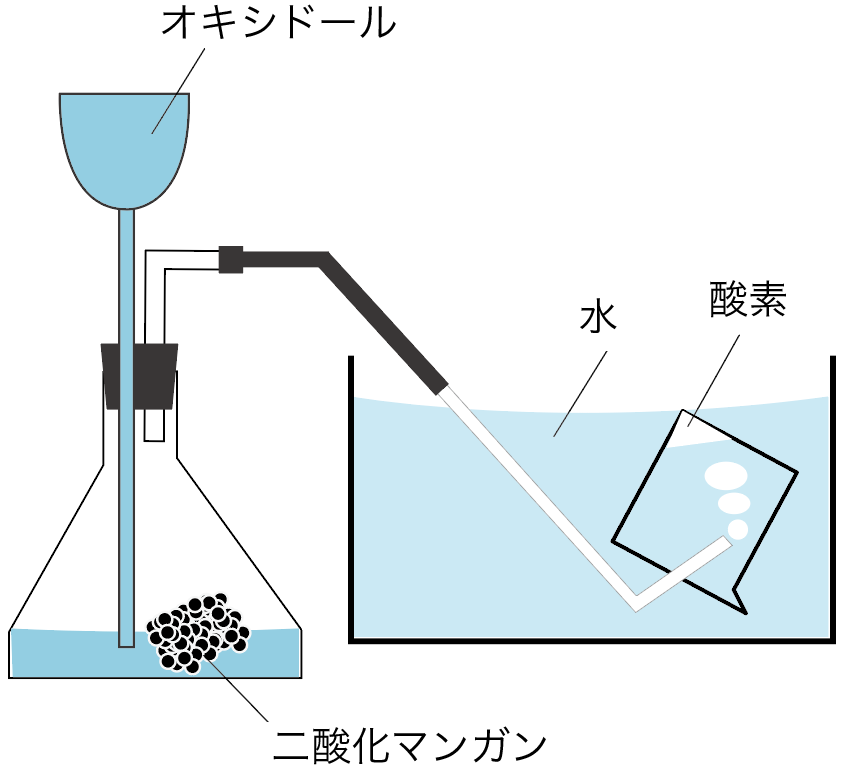
水上置換法と呼ばれてる気体の集め方だね。
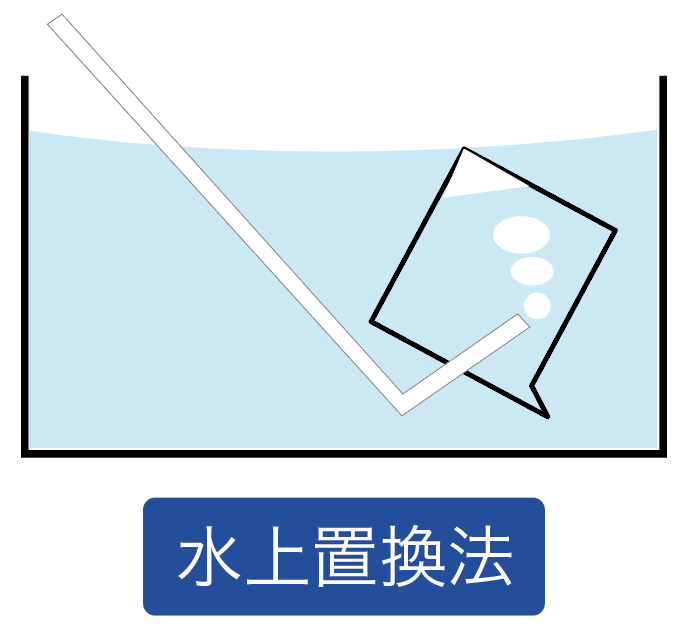
水が入った容器の中で、ビーカー内に水をフルマックスに満たす。
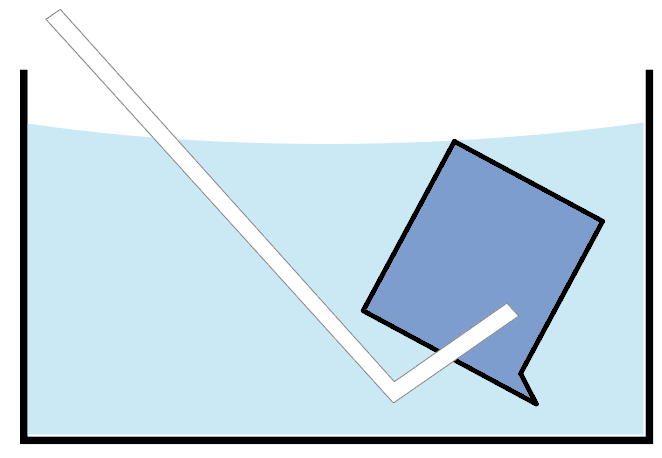
そして、そのビーカーの中に、集めたい気体の発生口を入れてやるんだ。
このビーカーの中に集めたい気体がどんどん入ってきて、もともと入っていた水たちが外に出て行っちゃうでしょ?
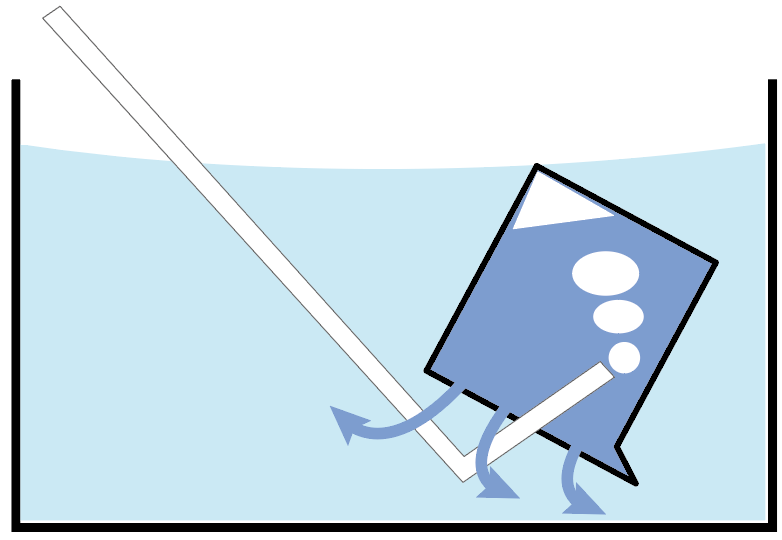
こんな感じで、もともとあった水と置き換えて、上に気体を集める方法を水上置換法と呼んでるわけね。
続いては、「空気」と気体を置き換えて集めていく方法だ。
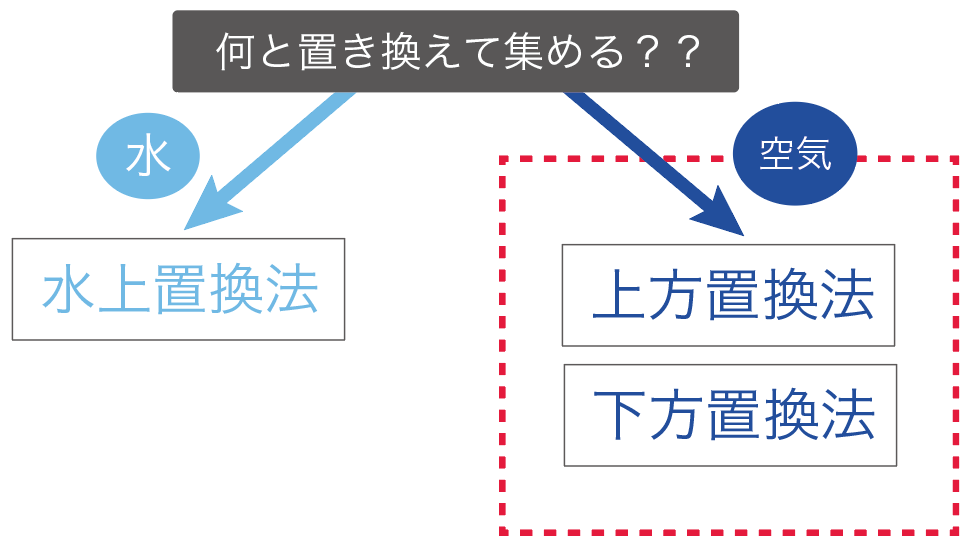
この空気と交換して集めていく方法は、
の2種類ある。
この気体の集め方は、試験管やビーカーに空気を集めていくことで、もともと入っていた空気を追い出し、集めたい空気に置き換えているわけ。
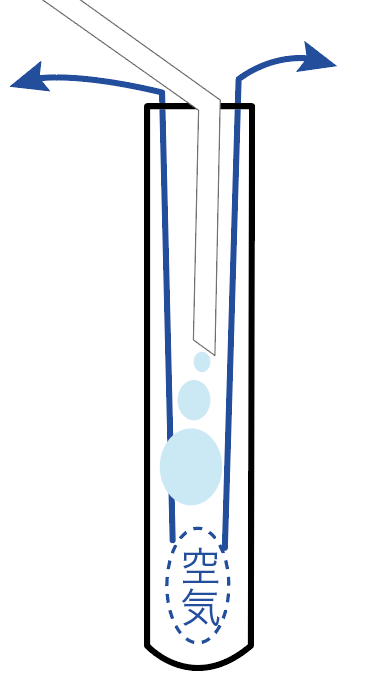
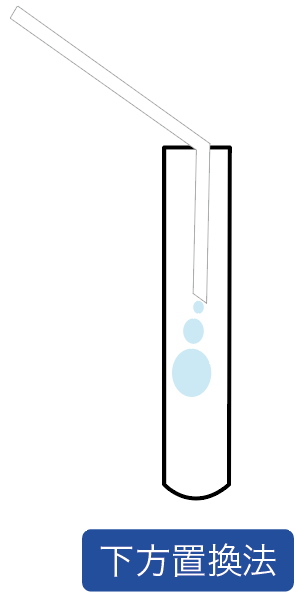
この「上方置換法」と「下方置換法」の違いはぶっちゃけ、
どこで気体を待ち構えて捕まえるか?
っていうことしか違わない。
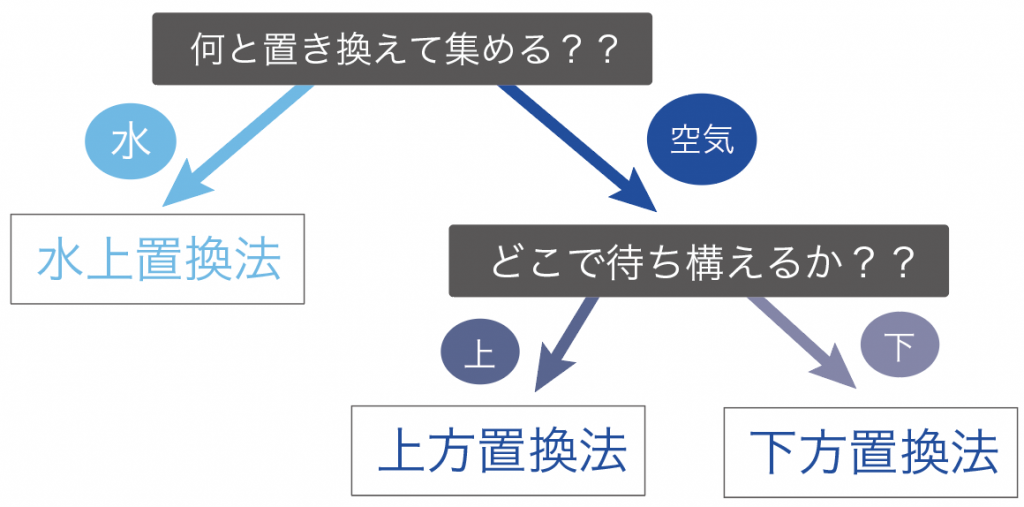
発生する気体を上の方で待ち構える気体の集め方を「上方置換法」、
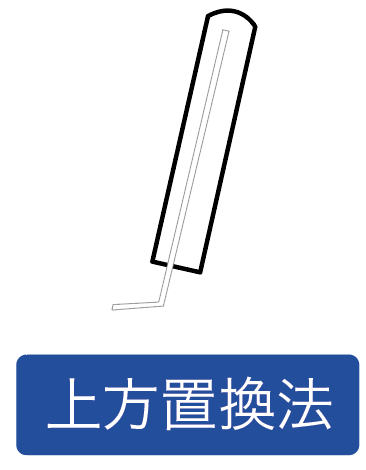
下の方で気体を待ち構える気体の集め方を「下方置換法」と呼んでいるわけ。
とまあこんな感じで、気体の集め方は、
という観点で考えるとわかりやすいね。
中学理科で勉強する気体の集め方は、
の3つあることがわかった。
でもさ、
いつ・どんな時にこの気体の集め方を使い分けたらいいんだろうね??
3つの気体の集め方をどれでも使っていいというわけではないでしょうよ?
気体の集め方の使い分けのポイントは次の2つ。
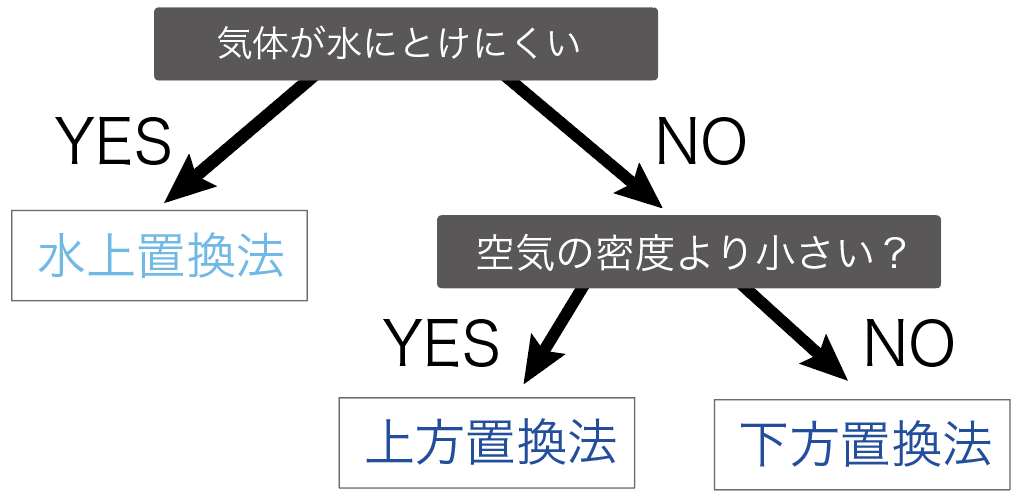
まずは、集めたい気体が水に溶けにくいかどうかで集め方を使い分けていくよ。
もし、集めたい気体が水に溶けにくい時は、
水上置換法
で集めていくよ。
水に溶けやすい時は、
のどっちかを使うことになるね。
なぜなら、水に溶けやすい気体を水上置換法で集めたら、気体が水に溶けちゃって、気体がなくなっちゃうからね。水溶液になっちまうよ。
たとえば、水にむちゃくちゃ溶けやすいアンモニアは水上置換法では集められない。
水上置換法で集められるのは、たとえば酸素だ。
酸素の性質には水に溶けにくいというやつがあったから、水と置き換えて集める水上置換法で集められるわけね。
次は、集めたい気体の密度をみてあげよう。
ただ、密度を調べるだけじゃなくて、
空気の密度より大きか小さいかを確認するんだ。
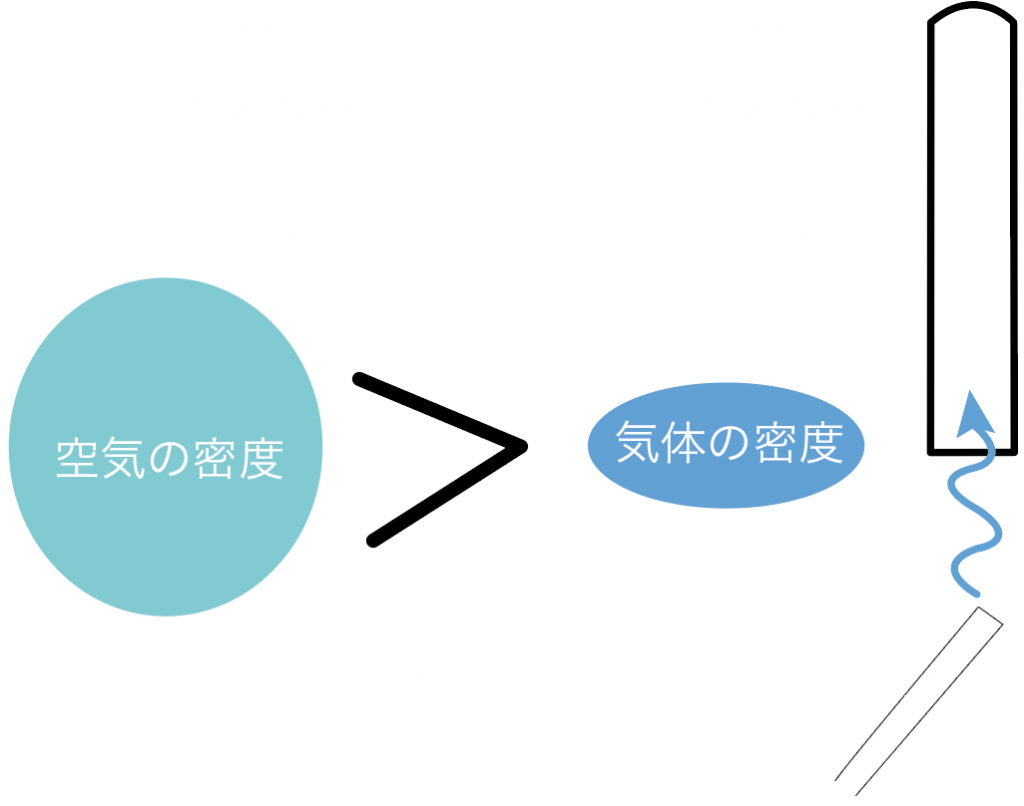
もし、空気の密度より気体の密度が小さかったら、
上方置換法
で集めるよ。
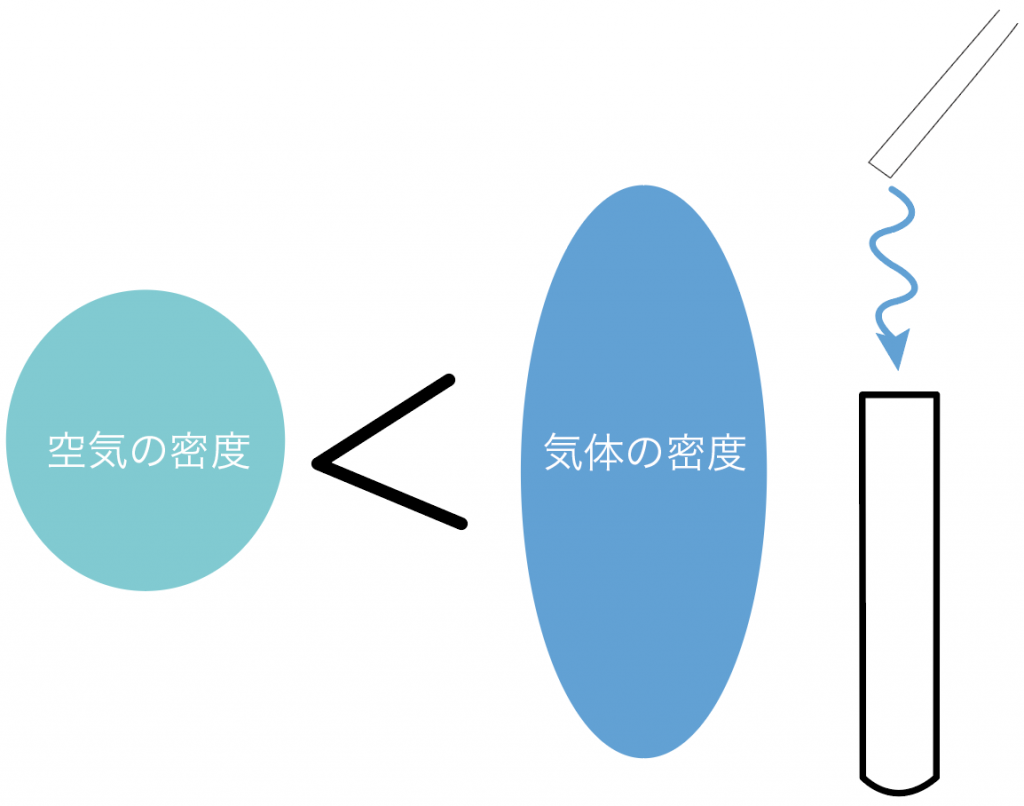
逆に、空気の密度より大きかったら、
下方置換法で集めるわけだ。

なぜかというと、集めたい気体の密度が空気の密度より小さいと、放っておいたらフラフラと上に上がって行っちゃう。
だから、その場合は、上で待ち構えて気体を集めていくべきなんだ。逃さないようにね。
逆に、集めたい気体の密度が空気の密度より大きい時は、下で待ち構えるのが良策。
なぜなら、放っておいたらフラフラと下に落ちてくるからね。
下でキャッチしてあげよう。
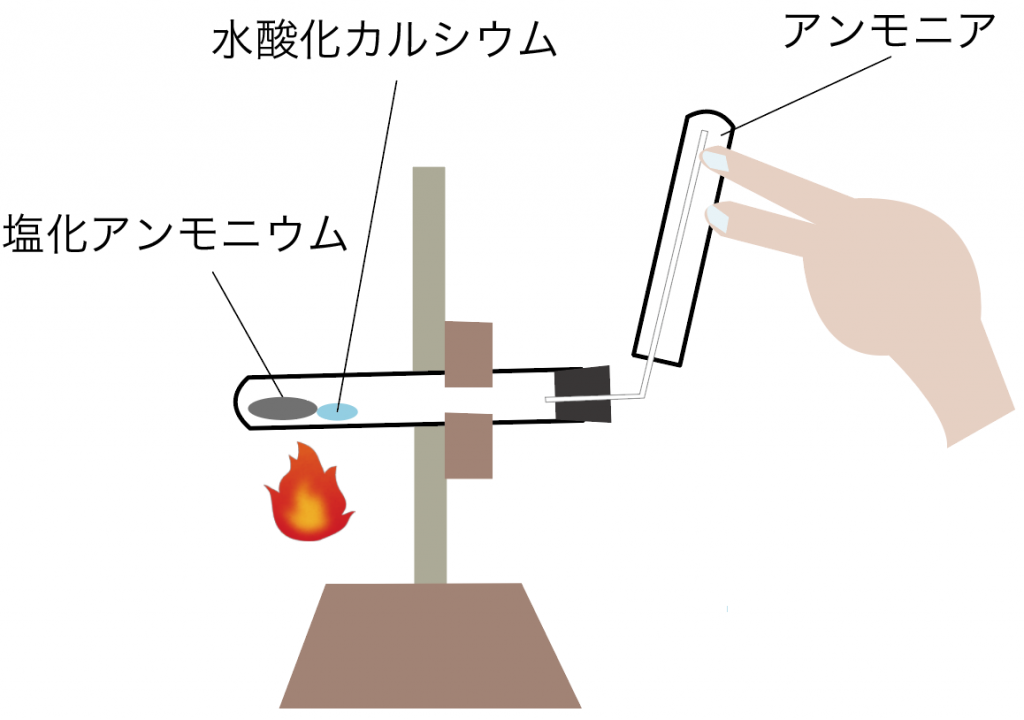
上方置換法の例としては、アンモニア。
水に溶けやすいから水上置換法は無理で、しかも空気よりも密度が小さいから上で待ち構える上方置換法で集めるんだ。
下方置換法の例としては、塩素や二酸化硫黄。
こいつらは水に溶けやすく、しかも、空気よりも密度が大きいからね。
以上が気体の集め方。
この記事では気体の集め方の種類と使い分けを見てきたね。
最後に、もう一度復習しておこう。
気体の集め方には、
の3つのタイプが存在していたけれど、こいつらは大きく分けると、
の2つの観点でうまく分類できたね。

んで、この3つの気体の集め方の使い分けは、
の2つの基準で判断していくんだったね。

水に溶けやすい気体は問答無用で水上置換法。

それ以外は、密度が気体の密度よりも大きかったら、下方置換法、

小さかったら、上方置換法を使ってあげよう。

そんじゃねー
Ken