こんにちは!この記事を書いているKenだよ。座りながら鍛えてるね。
中1理科の身のまわりの物質では、
再結晶
っていう用語を勉強していくよね。
日常で使わない言葉だから難しそうに聞こえる。。
だけどね、この前勉強した「溶解度曲線」を使えばなんとかしっくりくるもんなんだ。
今日は、溶解度曲線を使って再結晶とは何かを振り返っていこう。
まず「再結晶」をウィキペディアで調べてみよう。
合成または抽出などによって得られた粗結晶(純度の低い結晶)をより良質で不純物の少ない結晶へと成長させるための操作である
って書いてあるね。
難しそうな言葉がたくさん使われていて、正直よくわからない。
要はここでは、
不純物が混じっている物質を、ある動作(合成または抽出)によって、純粋にそれしか混じっていない良質な結晶を作ること
といっているね。
たとえば、物質AとBの混合物があったとして、ある動作をすることで、こいつから物質Aだけ取り出すことなわけだ。
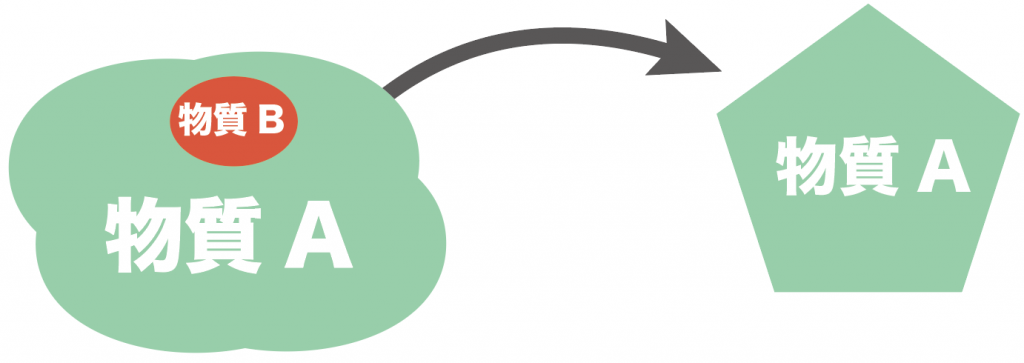
特に中学校で勉強する理科では、「溶解度の差」を利用して、純度の高い結晶を取り出していくよ。
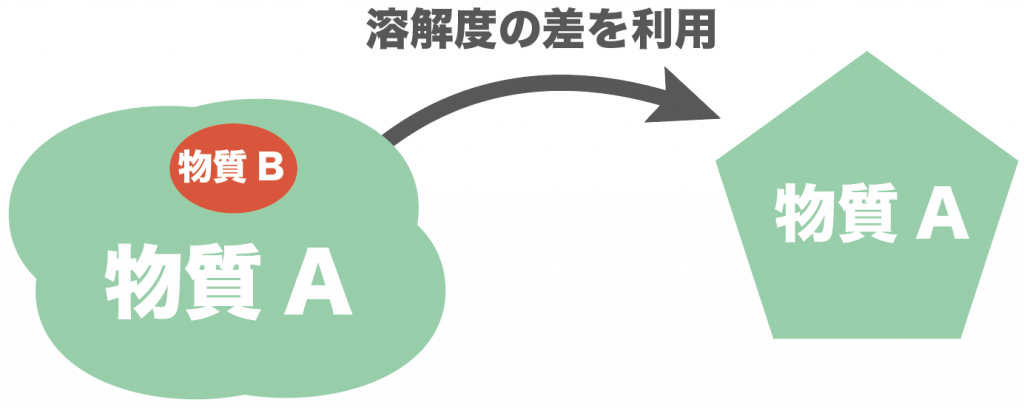
今日は、この溶解度の違いを利用した再結晶の方法をわかりやすく解説してみよう。
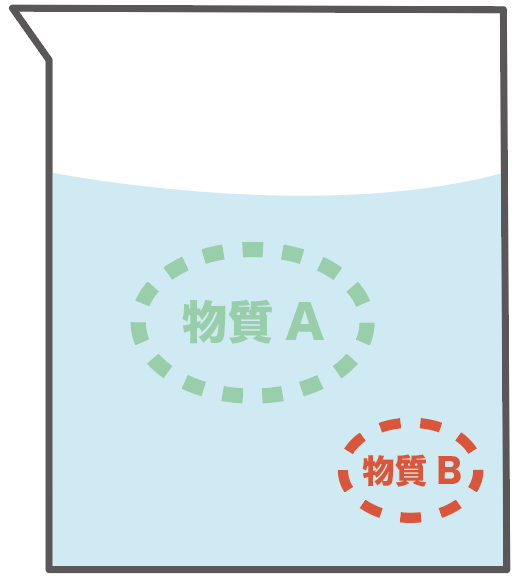
まず、Bが混じっちゃってる物質Aを想像してみて。

本当は物質Aだけが欲しいのに、どういうわけか、物質Bが不純物として混じってしまったんだ。
そこで君のボスは、
「不純物Bが入ってない物質Aだけの結晶が欲しい」
と言ってくる。

こういうときは、物質Aと物質Bの溶解度曲線の違いを利用して再結晶をしてみよう。
まず、不純物Bが混じった物質Aを水にとかしてみるんだ。
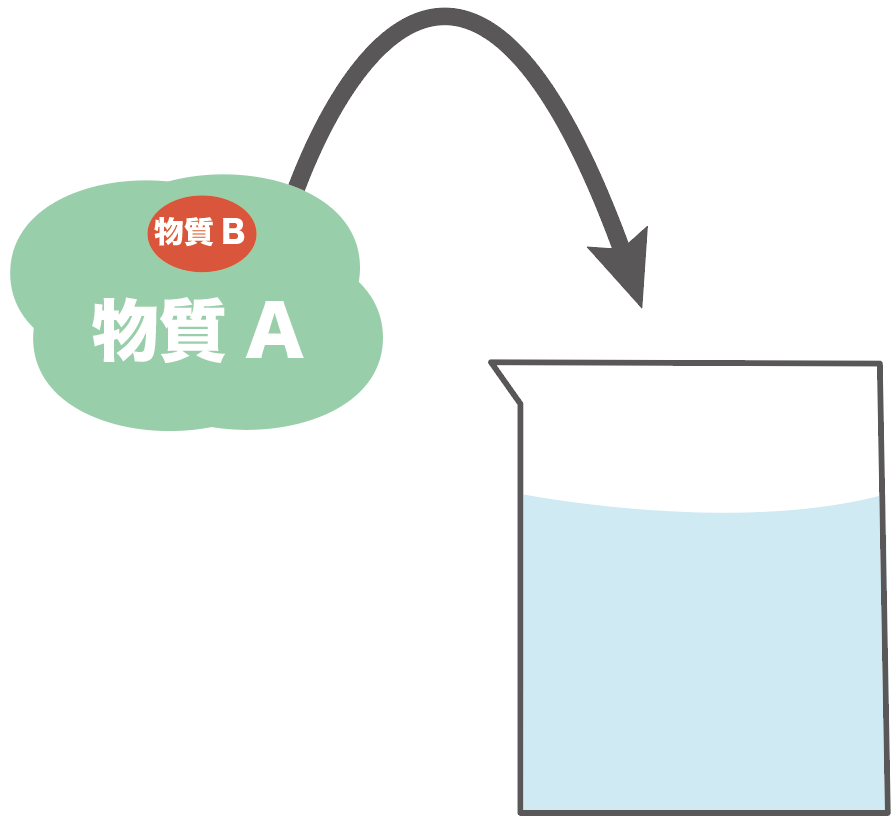
溶けて見えなくなるまでかき混ぜてみよう。
物質Aと物質Bが入り混じった水溶液を冷やしてみよう。
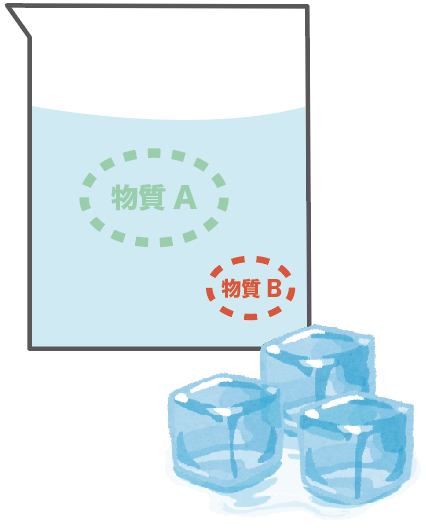
冷やすと何が起こるかっていうと、
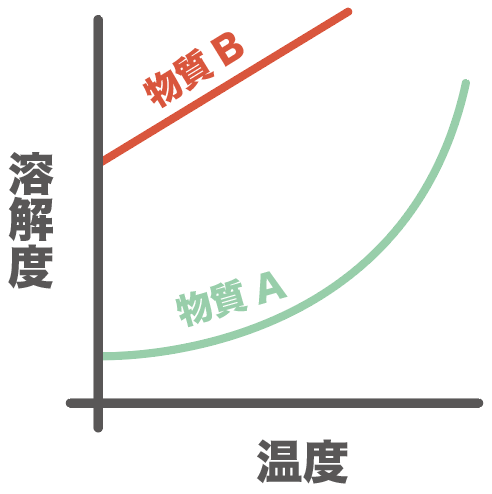
それぞれの物質の溶解度が変化するんだ。
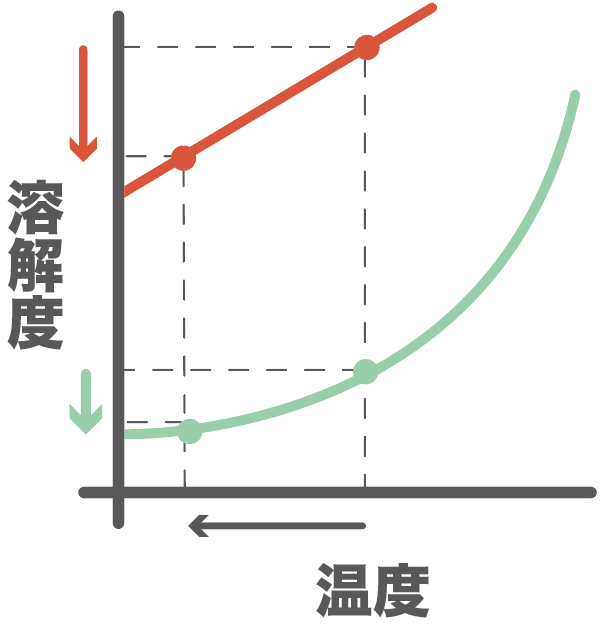
すると、さっきまで溶けていた物質Aの一部が、溶解度が小さくなったから、溶けきれなっちゃう。
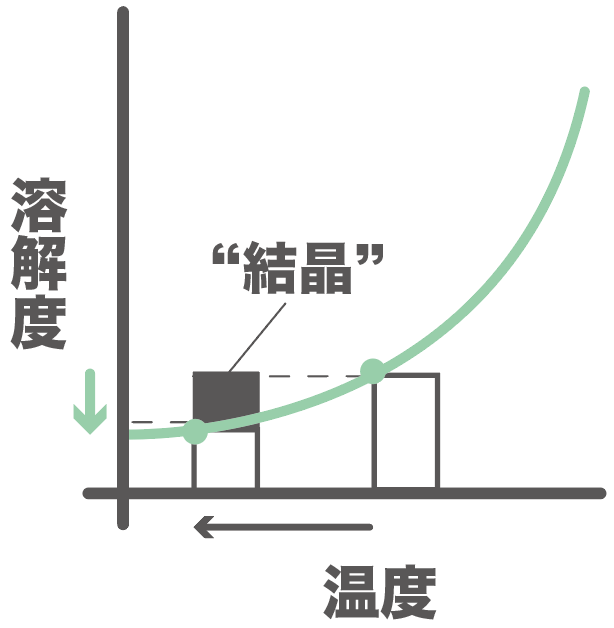
溶けきれなくなった分は、結晶として出てくるよ。
物質Bは少ししか含まれてなかったし、物質Aより溶解度が大きいから、冷やしてもまだ水に溶けられていたんだ。
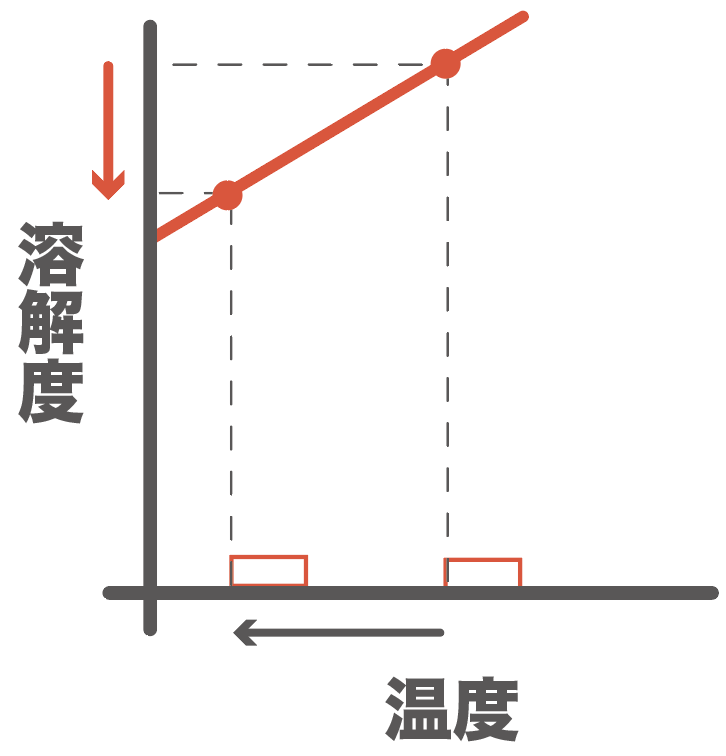
物質Aは十分すぎるほど水に溶けていて、溶解度より超えちゃった分があったんだ。
それが固体の結晶として出てくる。
物質Bはまだ溶解度が変化しても水に溶けていられたね?
だから、今回、結晶として得られたのは、
物質Aのみ、
だ。

こうして、物質Aと物質Bの混合物を水溶液に溶かして冷やすことで、結晶として純粋な物質Aだけを取り出せるわけね。
この一連の操作のことを、
再結晶
と呼んでいるんだね。
うん、しっくりしたぜ。
以上が再結晶のおおまかな流れね。
最後にもう一度復習しておこう。
物質Aに、不純物の物質Bが混じっちゃってて、

なんとか物質Aだけを取り出したいとき、再結晶を使うよ。
まず、混じった物質たちを水に溶かして、冷やして、溶解度を小さくすると、溶けきれなくなった物質Aが結晶で出てくる。

物質Bはちょっとしか含まれてなかったし、物質の性質上、温度が下がってもまだ十分な溶解度を持つことができたらしい。

ゆえに、冷やすと、溶けきれなくなった、物質A(純粋)が結晶として取り出せたんだね。

再結晶は狙われやすいからテスト前によーく復習しておこう。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。水と、生きてるね。
中1理科の「身のまわりの物質」という単元では、
という3つを習っていくよね??
漢字ばっかりでとっつきにくいけど、これらの用語はテストによく出てくる。マスターしておくことに越したことはないね。
そこで今日は、飽和水溶液・溶解度・溶解度曲線の3つをわかりやすく解説していくよ。
今回勉強していく、
は主に、
ある物質を水に溶かすときに使う理科の用語
なんだ。
まずはこのシチュエーションを頭の中で想像してみて。
ある物質を水に溶かすとき、じつは、
水は無限にその物質を溶けさせることはできない。
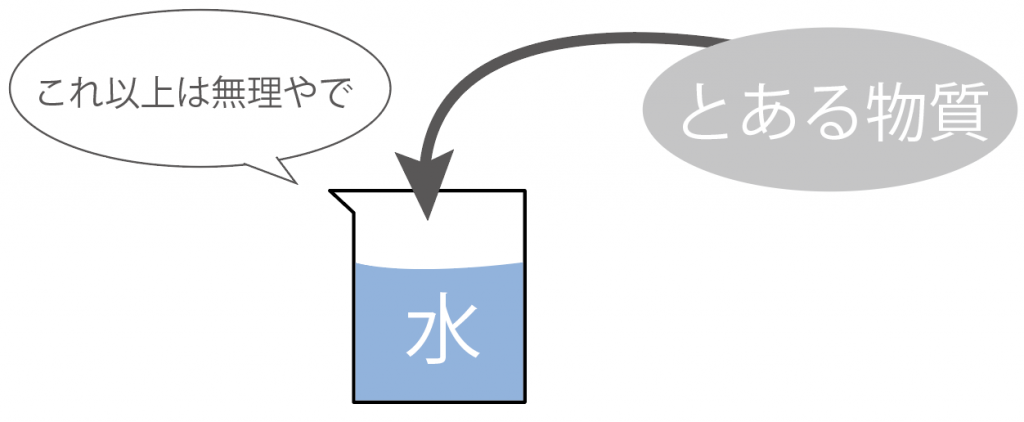
水には物質を溶けさせることができる限界ってもんがあるんだ。
んで、
ある物質が水の限界まで溶けきった水溶液のことを、
飽和水溶液
って呼んでいるのさ。
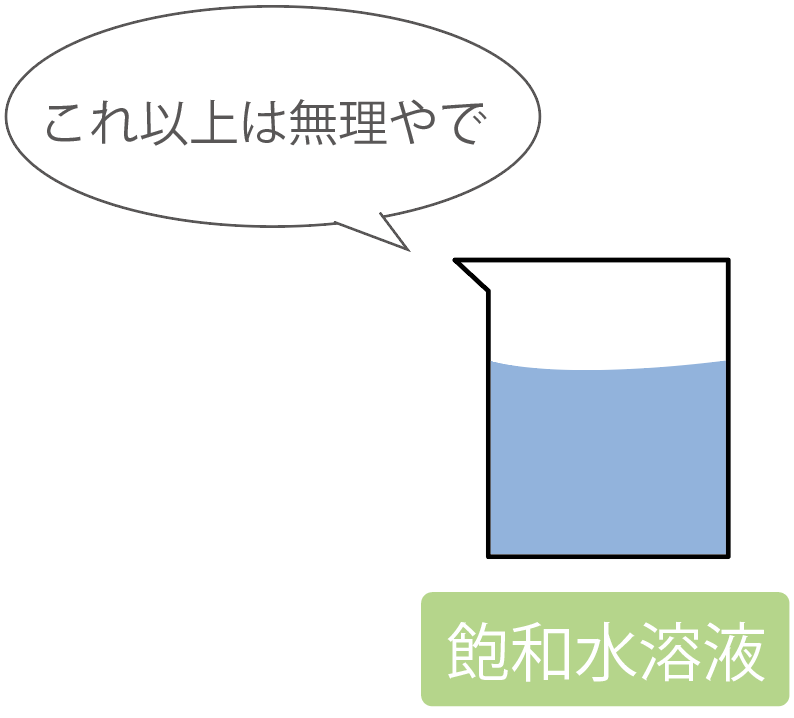
飽和水溶液にこれ以上その物質を加えてみても、その物質は溶けずに沈殿しちゃうだろうね。
飽和水溶液をつくるためにどれくらい物質を溶かしたのか?
を表したのが「溶解度」ね。
もっと具体的にいうと、
ある物質を水100gにとかして飽和水溶液にした時のとかした物質の量
のことさ。
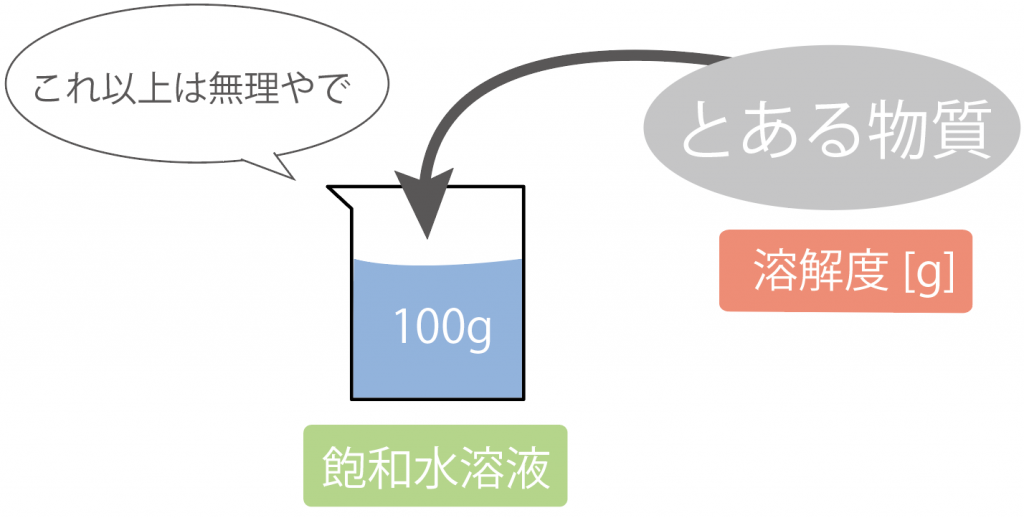
たとえば、水100gにミョウバンを混ぜまくって、ミョウバンの飽和水溶液を作ったとしよう。
このとき、ミョウバンを40g混ぜて飽和水溶液ができたとすると、このミョウバンの飽和水溶液の溶解度は40gさ。
じつは、この溶解度というものは、
温度によって変化することが知られているよ。
たとえば、20℃の時の溶解度が40gだったとしても、あぶって100℃にしたら溶解度が80gになることもあるわけだ。
この、水の温度によって溶解度が変化する様子をグラフにしたものを、
溶解度曲線(ようかいどきょくせん)
と呼んでいるよ。
この溶解度曲線というグラフは、
をとったものだね。
だいたいこんな感じ↓↓
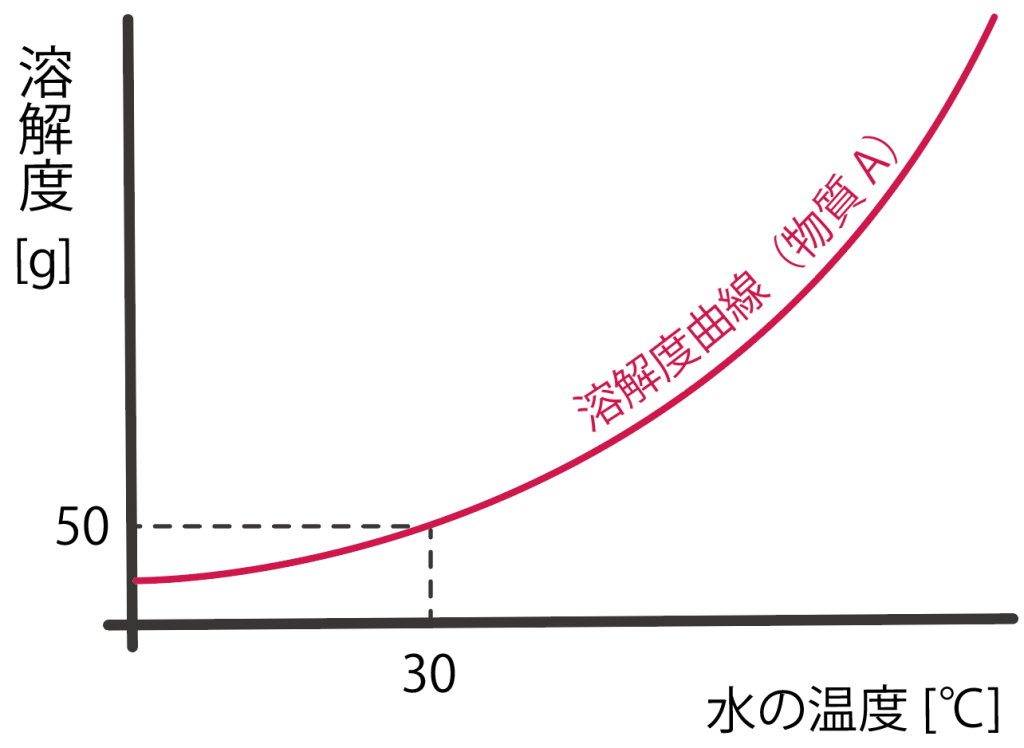
この溶解度曲線というグラフの読み取り方は簡単。
たとえば、物質Aの30℃の溶解度を知りたいときは、30℃の時の溶解度を溶解度曲線から読み取ってあげればいいんだ。
下の例だと、物質Aが30℃の時の溶解度は50gになりそうだね。
以上が飽和水溶液・溶解度・溶解度曲線だったね。
最後に復習しておこう。
っていう用語は全て、
ある物質が水に溶けるシチュエーション
で使う用語。

飽和水溶液とは、ある物質がこれ以上溶けきれないぐらい溶けきった水溶液のこと。
溶解度とは、ある物質が飽和水溶液に溶ける質量のことで、100gの水溶液に溶ける質量のこと。

溶解度曲線とは、温度ともに変化する溶解度の変化をグラフにしたものだったね。

これらの用語をマスターしたら、次は溶解度曲線の問題を解いてみよう!
そんじゃねー
Ken
こんにちは!この記事を書いてるKenだよ。のど飴100個ぐらいほしいね。
中1理科の身のまわりの物質では、たくさんの気体の性質を見てきたよね。
覚えることがいっぱいあって、逃げ出したくなる気持ちもよくわかる。頭も痛いぜ。
だがしかし、気体の性質を調べるためには、まず、
気体を捕まえなきゃいけない。
気体を集めないことには、性質を調べたり、実験とかできないからね。
そこで今日は、そんな気体の勉強の基本中の基本ともいえる、
気体の集め方・作り方
を詳しく図を使ってみていこう。
中学の理科では、次の3つの気体の集め方を勉強していくね。
この3つの気体の集め方は正直、名前も似てるし、覚えづらい。
そこで、この気体の集め方の種類の分類と、こいつらを使い分ける方法を見ていこう。
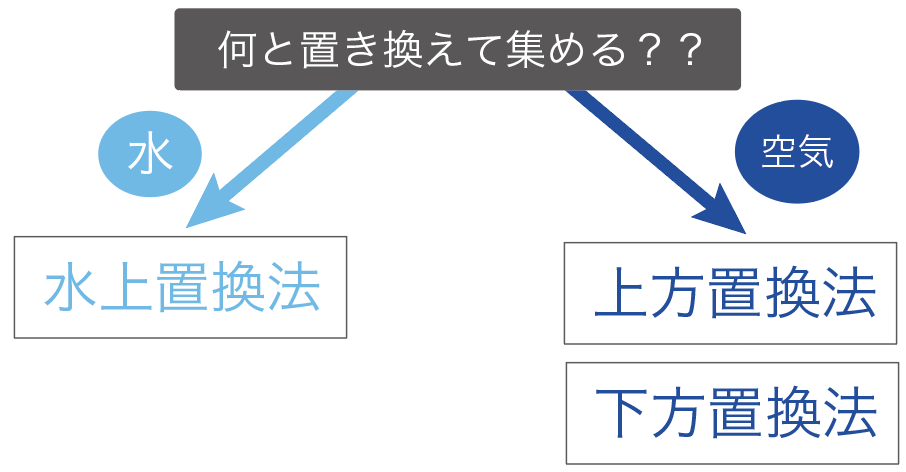
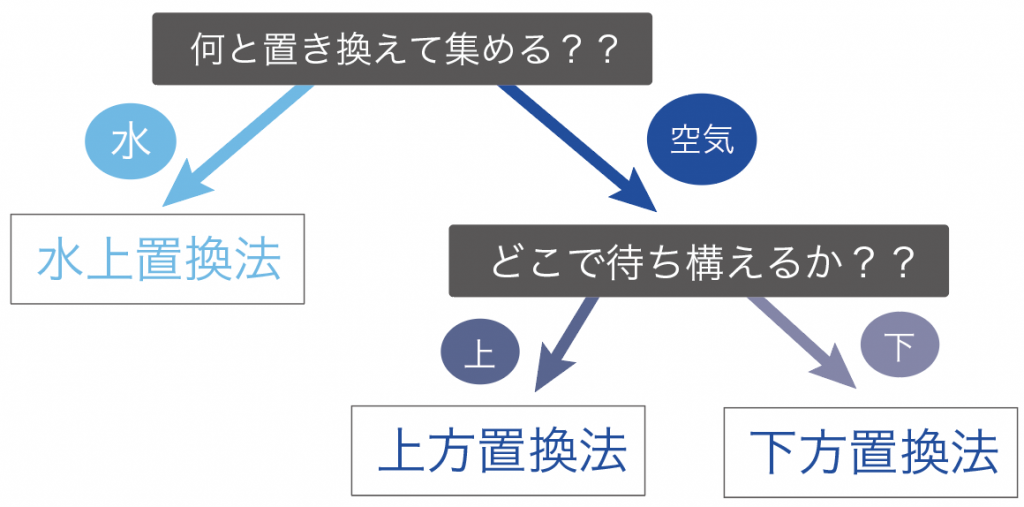
中学理科で勉強する気体の集め方は、次の2点の観点で分類していくと覚えやすいよ。
気体の集め方で重要なのは、
「何」と気体を置き換えて集めていくか?
ってことだ。
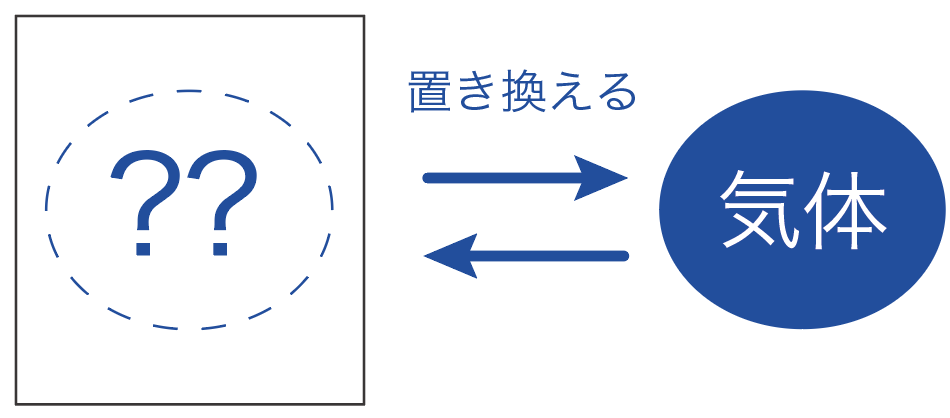
気体の集め方では、
の2通りの集め方に分けることができるんだよ。
まず、「水」と気体を置き換えて、気体を集めていく方法だ。
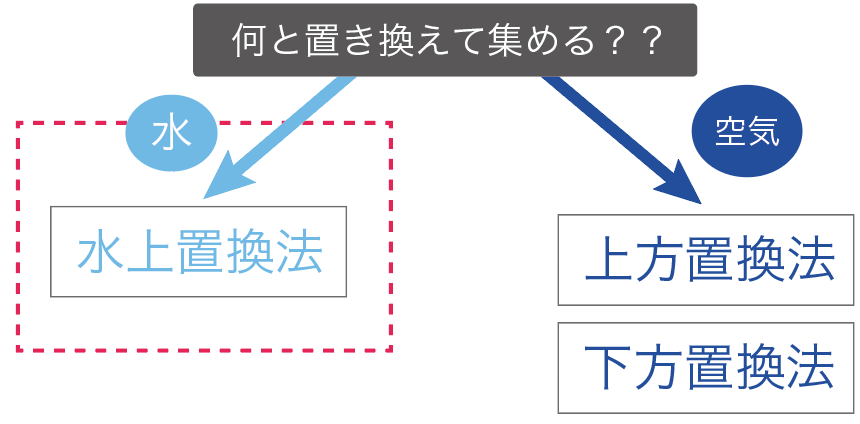
水と置き換える気体の集め方は1つしかない。
水上置換法と呼ばれてる気体の集め方だね。
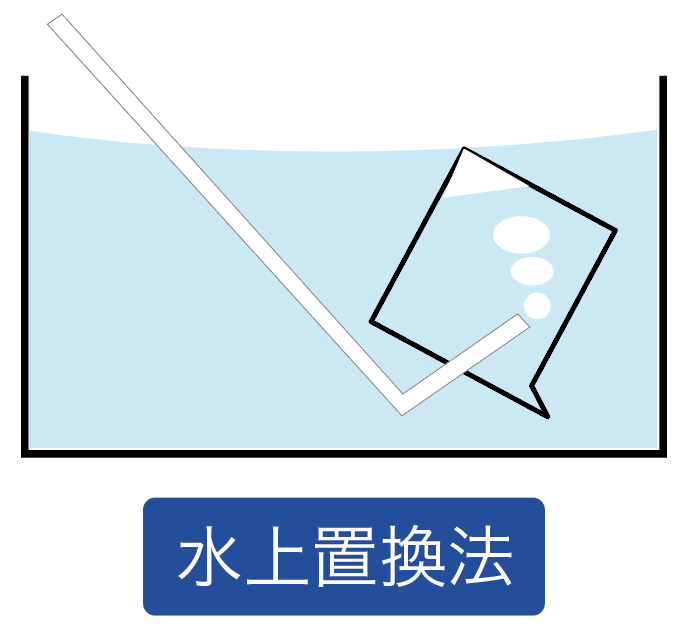
水が入った容器の中で、ビーカー内に水をフルマックスに満たす。
そして、そのビーカーの中に、集めたい気体の発生口を入れてやるんだ。
このビーカーの中に集めたい気体がどんどん入ってきて、もともと入っていた水たちが外に出て行っちゃうでしょ?
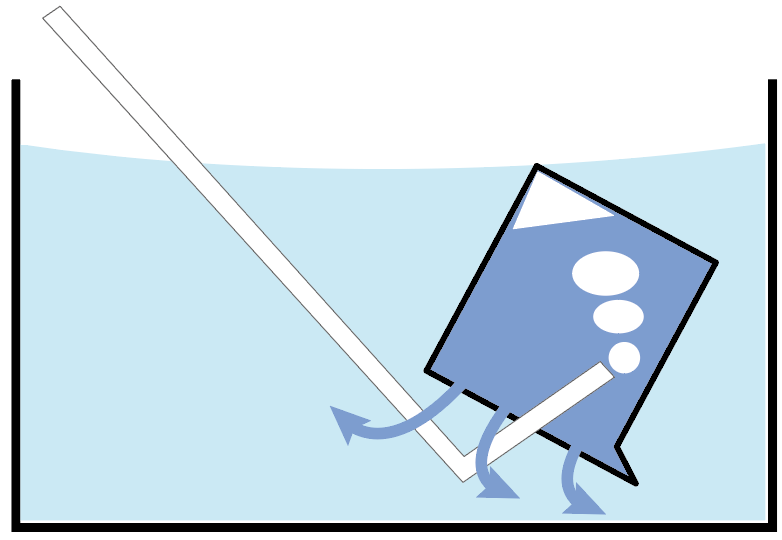
こんな感じで、もともとあった水と置き換えて、上に気体を集める方法を水上置換法と呼んでるわけね。
続いては、「空気」と気体を置き換えて集めていく方法だ。
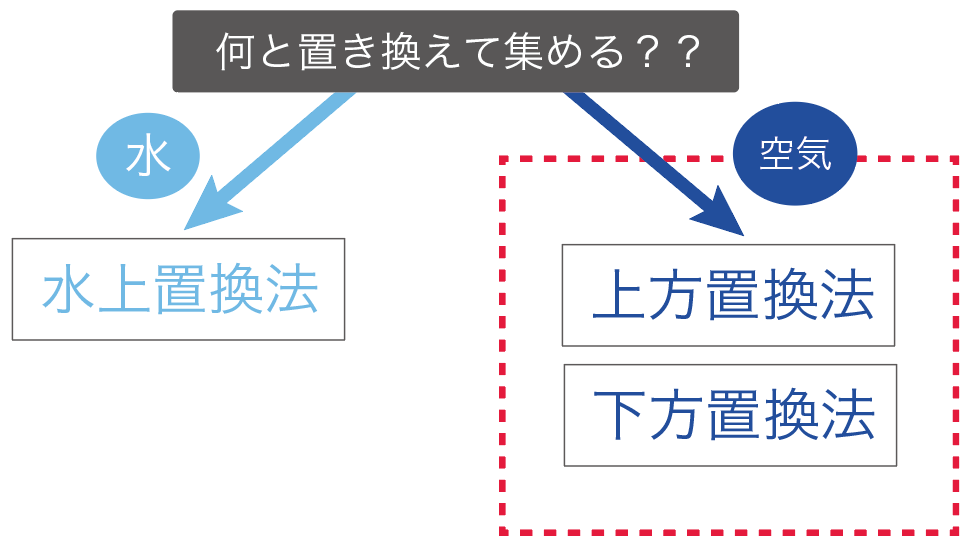
この空気と交換して集めていく方法は、
の2種類ある。
この気体の集め方は、試験管やビーカーに空気を集めていくことで、もともと入っていた空気を追い出し、集めたい空気に置き換えているわけ。
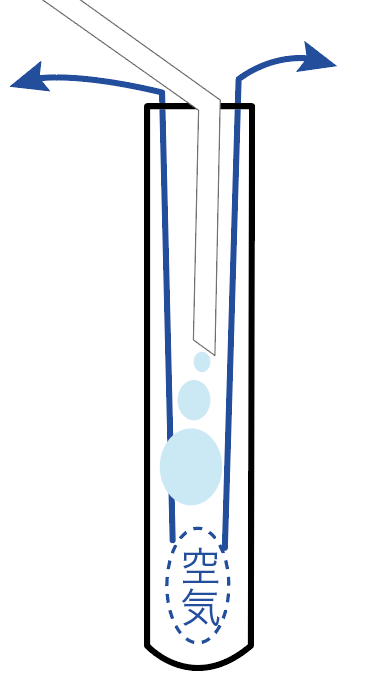
この「上方置換法」と「下方置換法」の違いはぶっちゃけ、
どこで気体を待ち構えて捕まえるか?
っていうことしか違わない。
発生する気体を上の方で待ち構える気体の集め方を「上方置換法」、

下の方で気体を待ち構える気体の集め方を「下方置換法」と呼んでいるわけ。
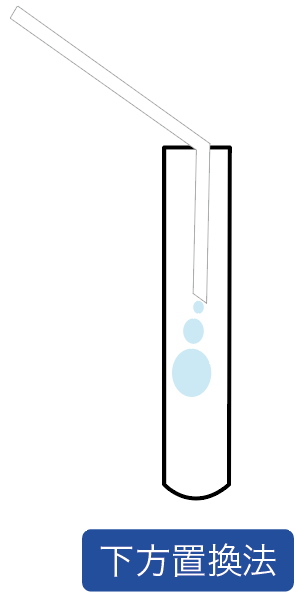
とまあこんな感じで、気体の集め方は、
という観点で考えるとわかりやすいね。
中学理科で勉強する気体の集め方は、
の3つあることがわかった。
でもさ、
いつ・どんな時にこの気体の集め方を使い分けたらいいんだろうね??
3つの気体の集め方をどれでも使っていいというわけではないでしょうよ?
気体の集め方の使い分けのポイントは次の2つ。
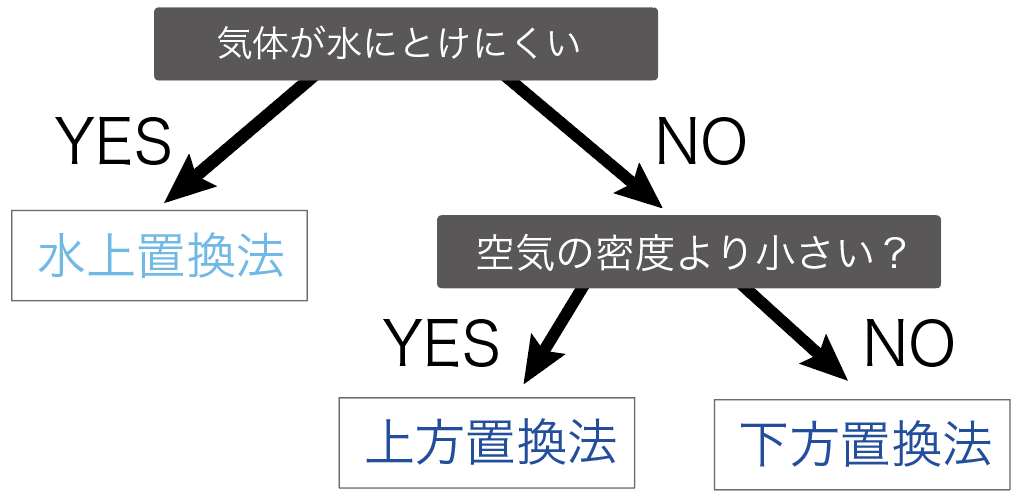
まずは、集めたい気体が水に溶けにくいかどうかで集め方を使い分けていくよ。
もし、集めたい気体が水に溶けにくい時は、
水上置換法
で集めていくよ。
水に溶けやすい時は、
のどっちかを使うことになるね。
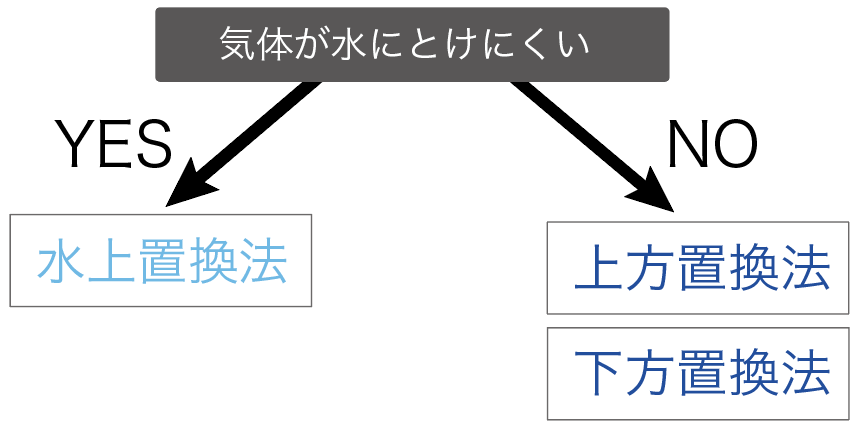
なぜなら、水に溶けやすい気体を水上置換法で集めたら、気体が水に溶けちゃって、気体がなくなっちゃうからね。水溶液になっちまうよ。
たとえば、水にむちゃくちゃ溶けやすいアンモニアは水上置換法では集められない。
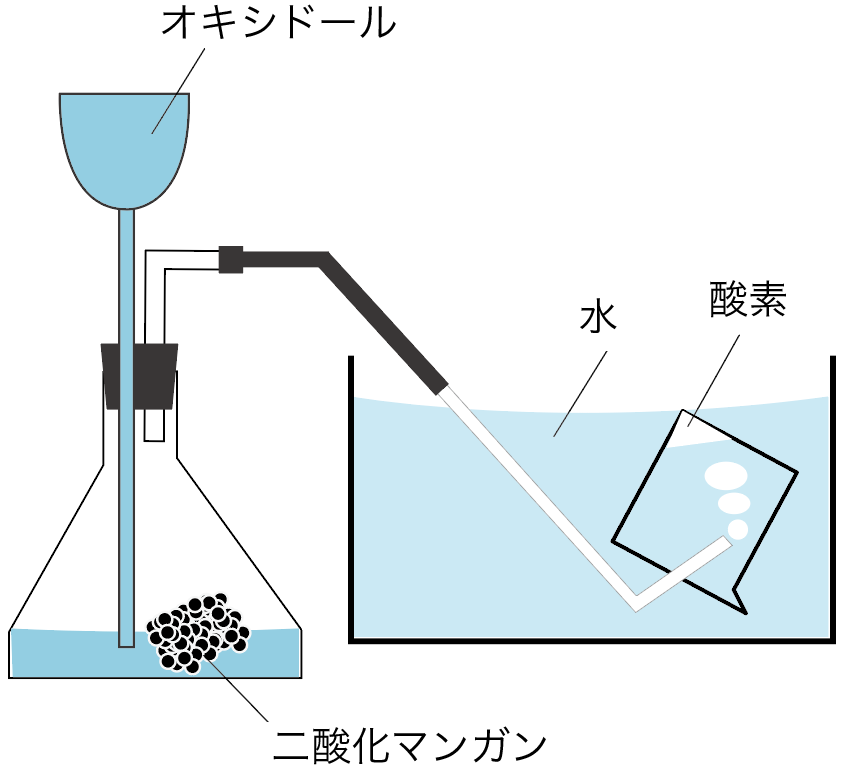
水上置換法で集められるのは、たとえば酸素だ。
酸素の性質には水に溶けにくいというやつがあったから、水と置き換えて集める水上置換法で集められるわけね。
次は、集めたい気体の密度をみてあげよう。
ただ、密度を調べるだけじゃなくて、
空気の密度より大きか小さいかを確認するんだ。
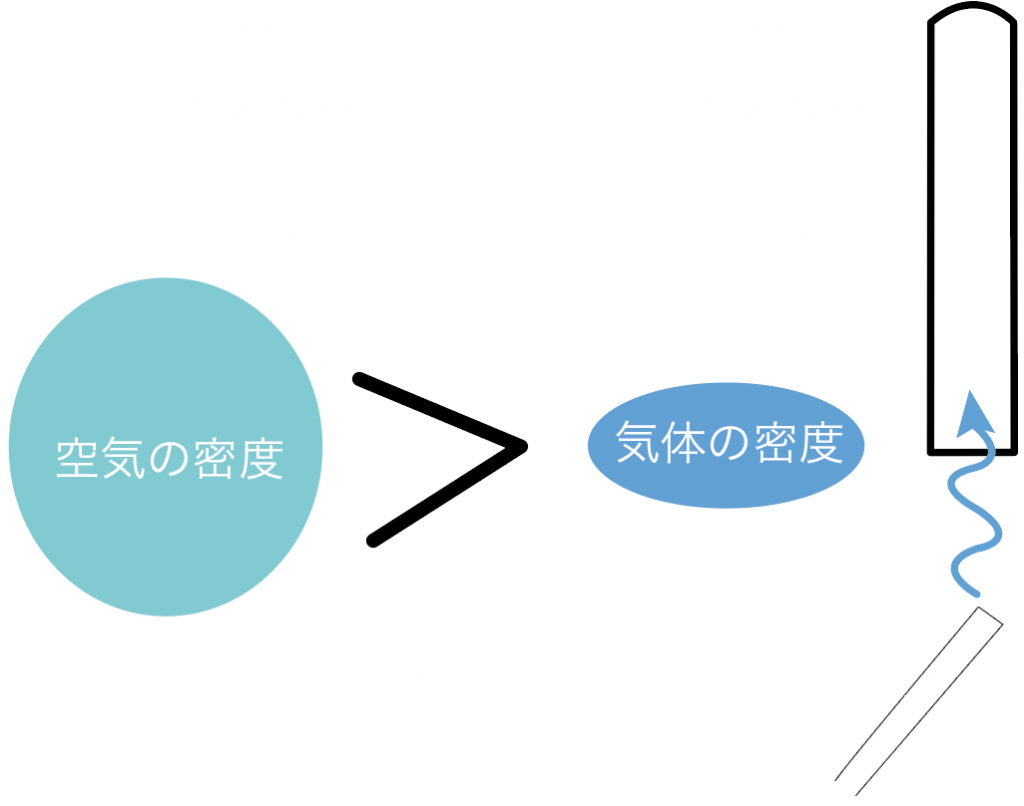
もし、空気の密度より気体の密度が小さかったら、
上方置換法
で集めるよ。
逆に、空気の密度より大きかったら、
下方置換法で集めるわけだ。

なぜかというと、集めたい気体の密度が空気の密度より小さいと、放っておいたらフラフラと上に上がって行っちゃう。
だから、その場合は、上で待ち構えて気体を集めていくべきなんだ。逃さないようにね。
逆に、集めたい気体の密度が空気の密度より大きい時は、下で待ち構えるのが良策。
なぜなら、放っておいたらフラフラと下に落ちてくるからね。
下でキャッチしてあげよう。
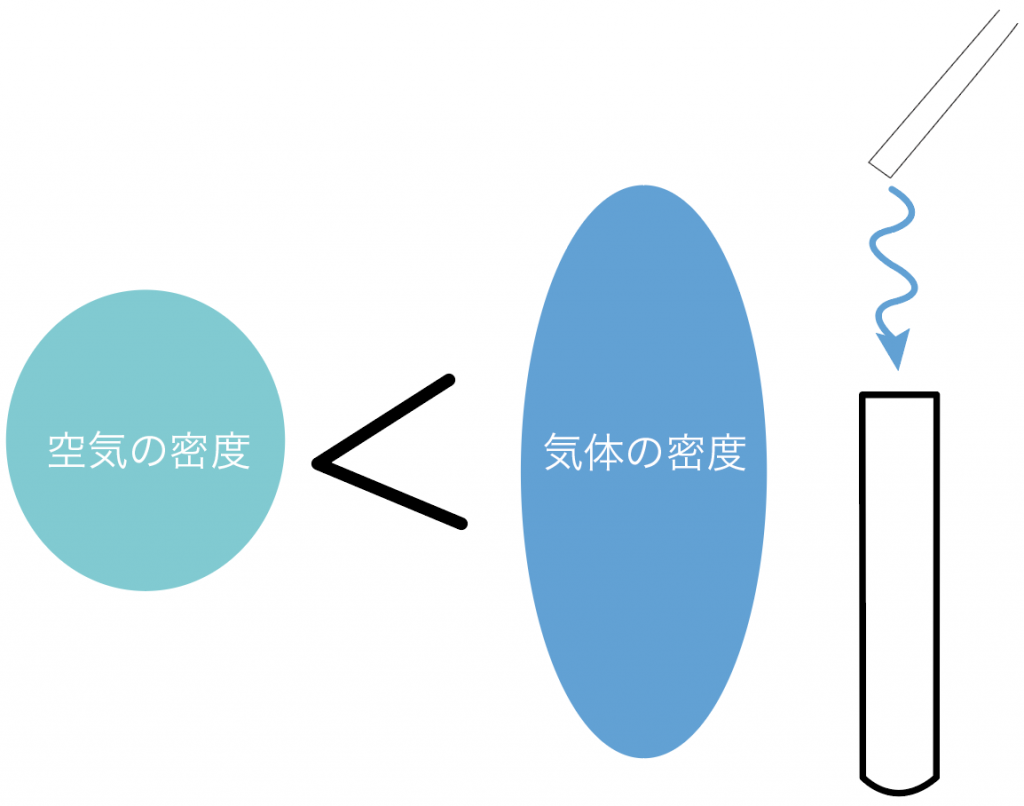
上方置換法の例としては、アンモニア。
水に溶けやすいから水上置換法は無理で、しかも空気よりも密度が小さいから上で待ち構える上方置換法で集めるんだ。
下方置換法の例としては、塩素や二酸化硫黄。
こいつらは水に溶けやすく、しかも、空気よりも密度が大きいからね。
以上が気体の集め方。
この記事では気体の集め方の種類と使い分けを見てきたね。
最後に、もう一度復習しておこう。
気体の集め方には、
の3つのタイプが存在していたけれど、こいつらは大きく分けると、
の2つの観点でうまく分類できたね。

んで、この3つの気体の集め方の使い分けは、
の2つの基準で判断していくんだったね。

水に溶けやすい気体は問答無用で水上置換法。

それ以外は、密度が気体の密度よりも大きかったら、下方置換法、

小さかったら、上方置換法を使ってあげよう。

そんじゃねー
Ken
こんにちは!この記事を書いてるKenだよ。浮き足立ってるね。
中1理科の「身のまわりの物質」という単元では、色々な実験をやっていくけど、中でも興味深くて面白いのが、
アンモニアの噴水実験
という実験だ。
これは簡単にいうと、
アンモニア(気体)が入ったフラスコに水をちょっと入れると、下から水が吸い上げられれて噴水みたいに溢れ出る
っていう実験だ。
今日は、このアンモニア噴水実験の手順と、なぜ、このような噴水現象が起きるのかという原理、仕組みまでみていこう。
まずはアンモニアの噴水実験で必要な実験器具をみていこう。
この実験では、
が必要になってくるよ。
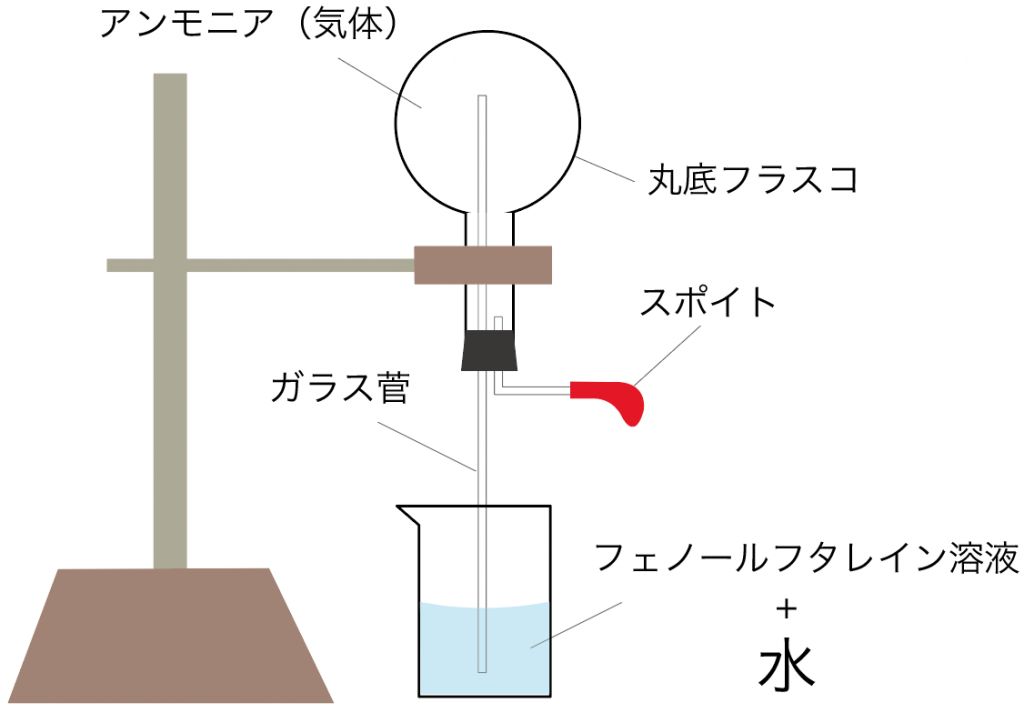
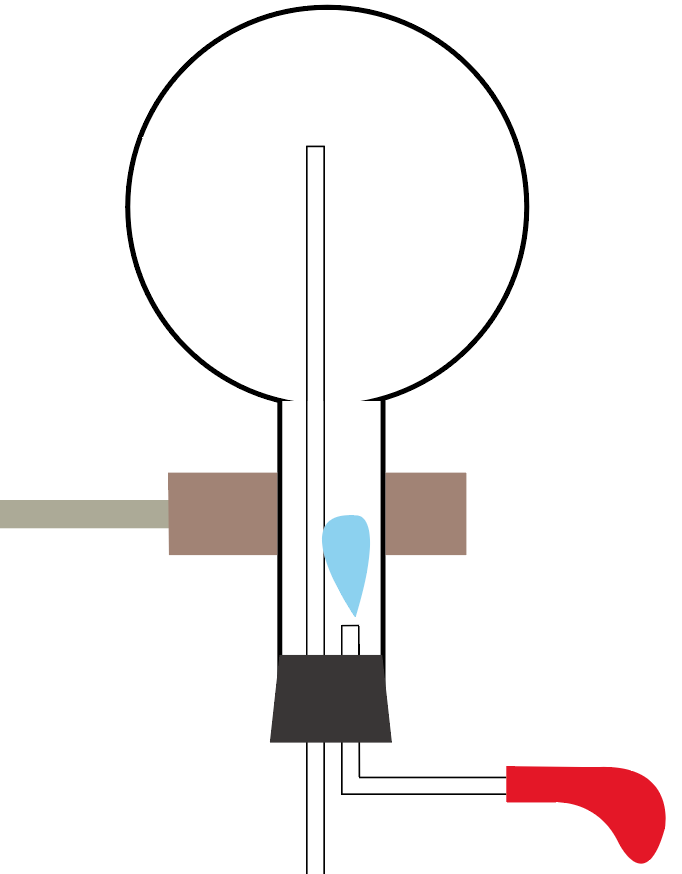
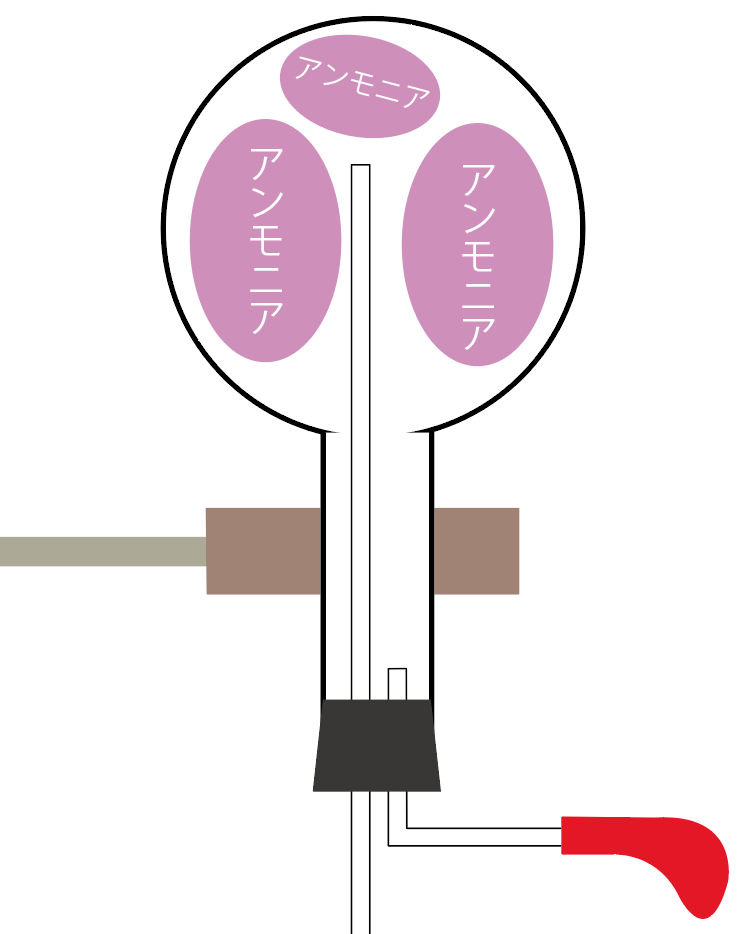
アンモニアの噴水実験で使う実験器具は下の図のようになるね。
アンモニアの噴水実験の手順は次の4ステップを踏むといいよ。
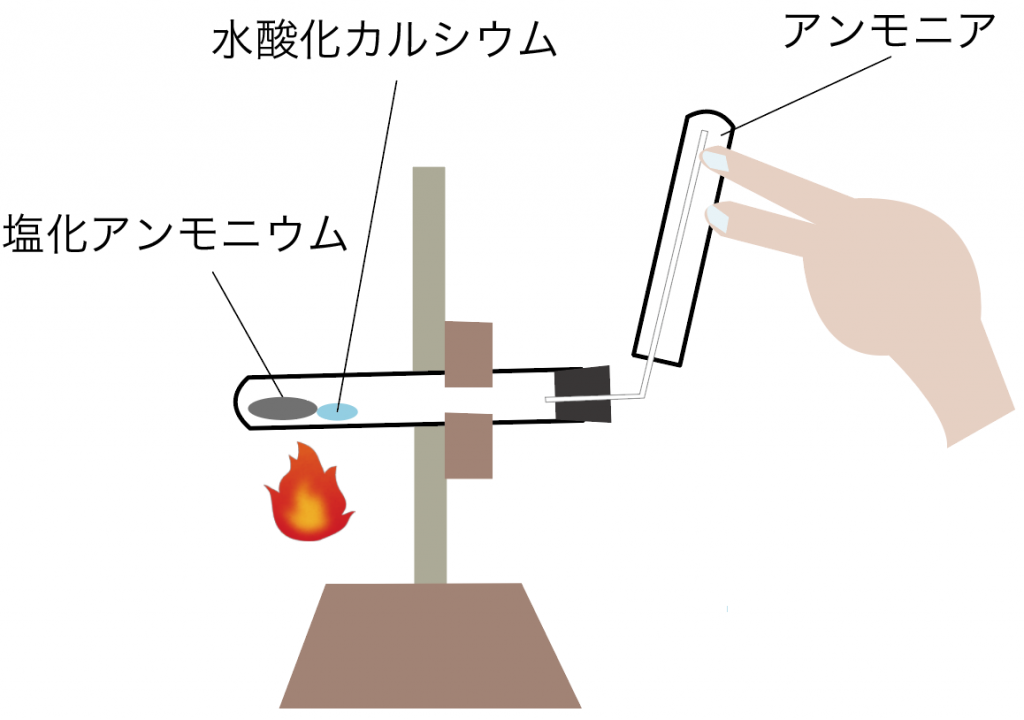
まずは噴水実験で使うアンモニアの気体を、丸底フラスコに集めてみよう。
上方置換法
を使うんだったね。

水に溶けやすくて、密度が空気より小さいアンモニアはこの方法で集めるのが鉄則だ。
丸底フラスコいっぱいに気体のアンモニアを集めたら準備完了ね。
丸底フラスコに、気体のアンモニアを注入し終わったら実験器具をセッティングしてみよう。

スポイトには水をいれておいてね。
それじゃあ、スポイトで丸底フラスコに水を入れてみよう。
ぴゅっと水をたらせばいいんだ、ぴゅっと。
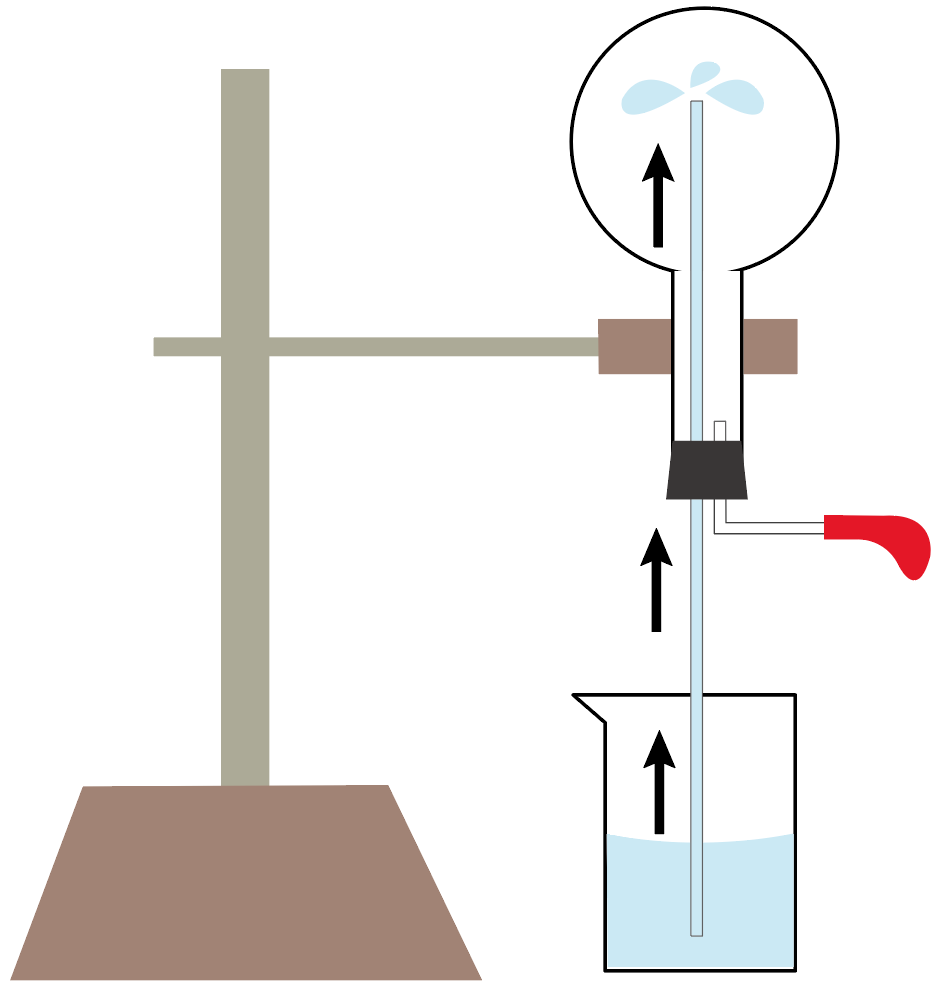
すると、どうだろう??
丸底フラスコの下にセットしていた水(フェノールフタレイン溶液入り)が、ガラス管を伝って、ぐんぐん丸底フラスコに吸い上げられていくではないか。
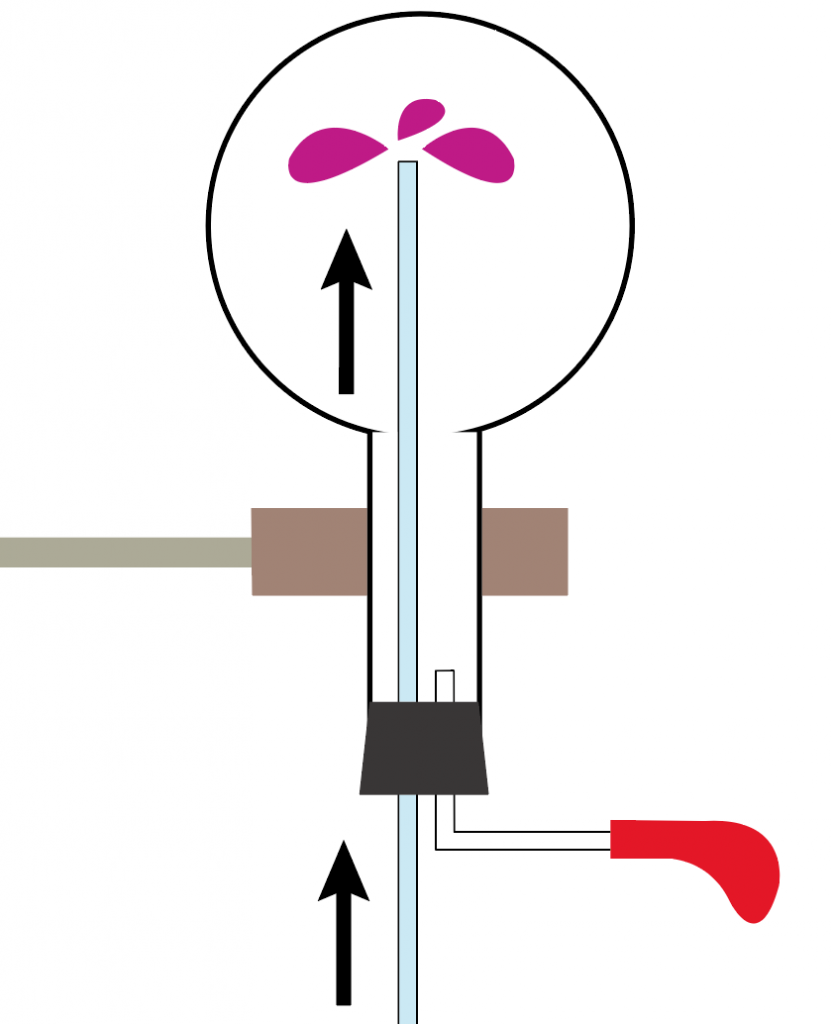
ガラス管を伝って、丸底フラスコに溢れ出たフェノールフタレイン溶液入りの水は、すぐに変色。
透明だったフェノールフタレイン溶液が、赤色に変化するね。
ってことで、こんな感じで、ガラス管から溢れ出だフェノールフタレイン溶液入りの水が、変色しながら丸底フラスコの中に溜まっていくわけだ。
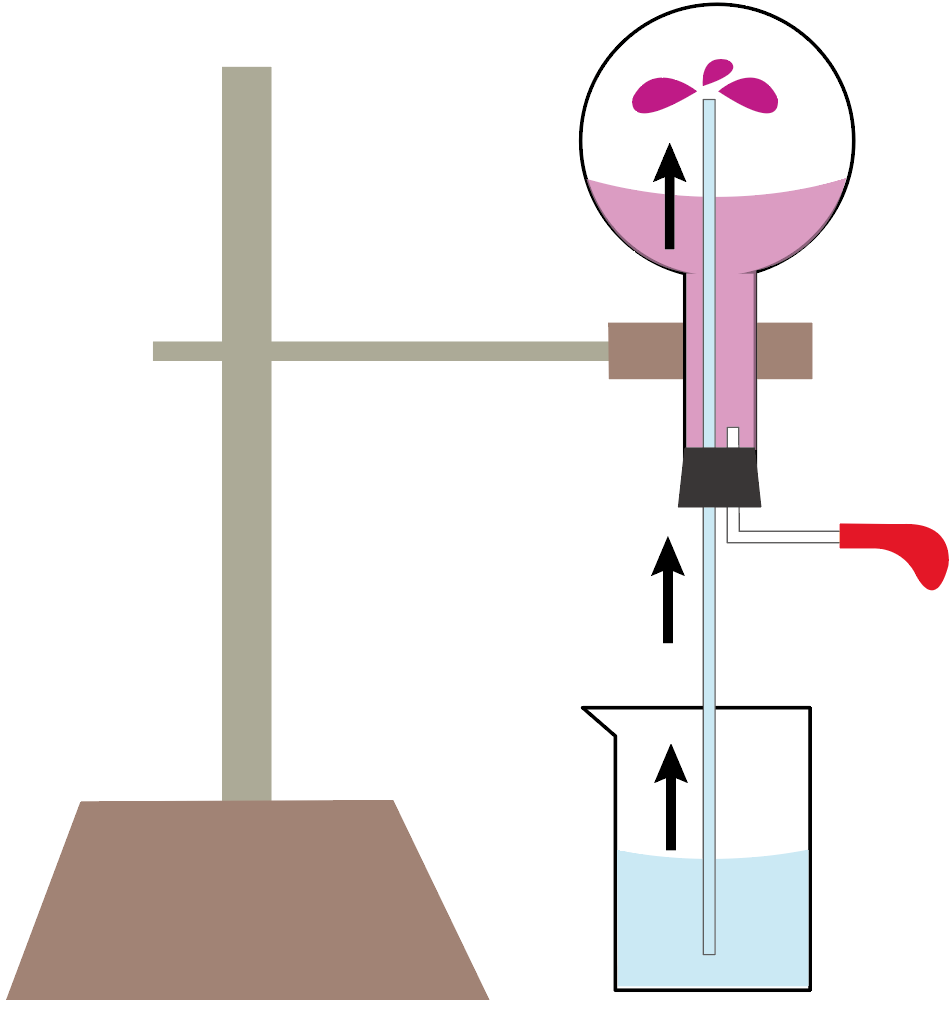
これでアンモニアの噴水実験終了。
それじゃあ、なんで、このアンモニア噴水実験が起こるんだろうね??
原理とか仕組みを知りたいよね。
順を追って、アンモニア噴水実験の仕組みを追っていこう。
まず、アンモニアの噴水実験の2ステップ目で、丸底フラスコに水をスポイトで入れたよね?
このとき、
丸底フラスコ内にあったアンモニアの気体が、
そのスポイトで入れた水に溶けちゃったんだ。
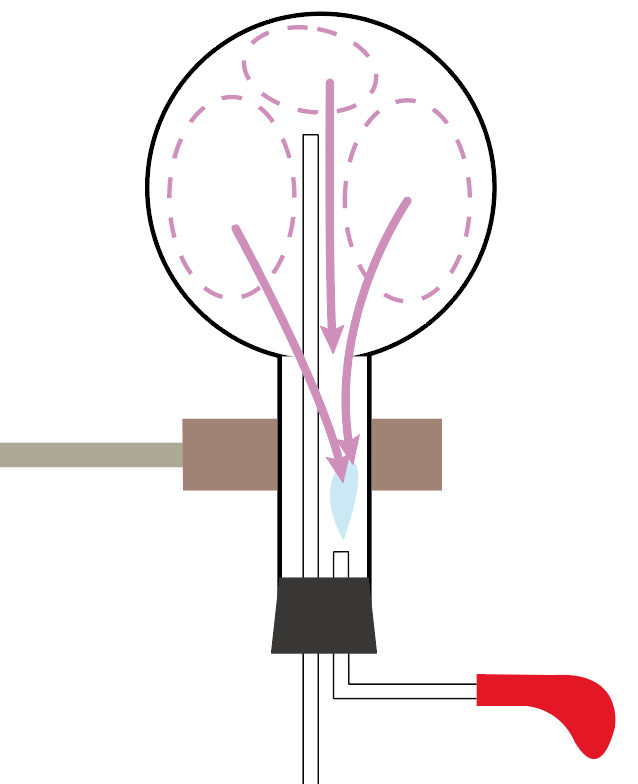
アンモニアの性質には、
水に溶けやすい
っていうやつがあったでしょ??
だから、ちょっとの水を入れただけで、気体のアンモニアは水に溶けちゃったんだよ。
丸底フラスコの中身は、もともとあった気体のアンモニアがなくなっちゃって、真空状態。
気体が何も入ってない空っぽの状態ってわけさ。
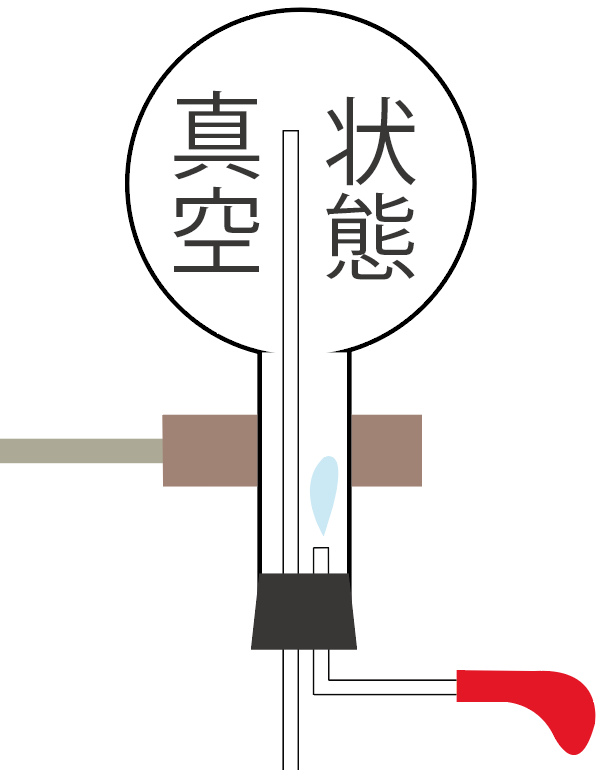
ってことは、丸底フラスコの中の圧力はすごい小さくなっちゃった。
アンモニアの気体がなくなっちゃって、何も入ってないからね。
だから、この隙間に、周りの空気がどんどん入ってこようとするんだ。
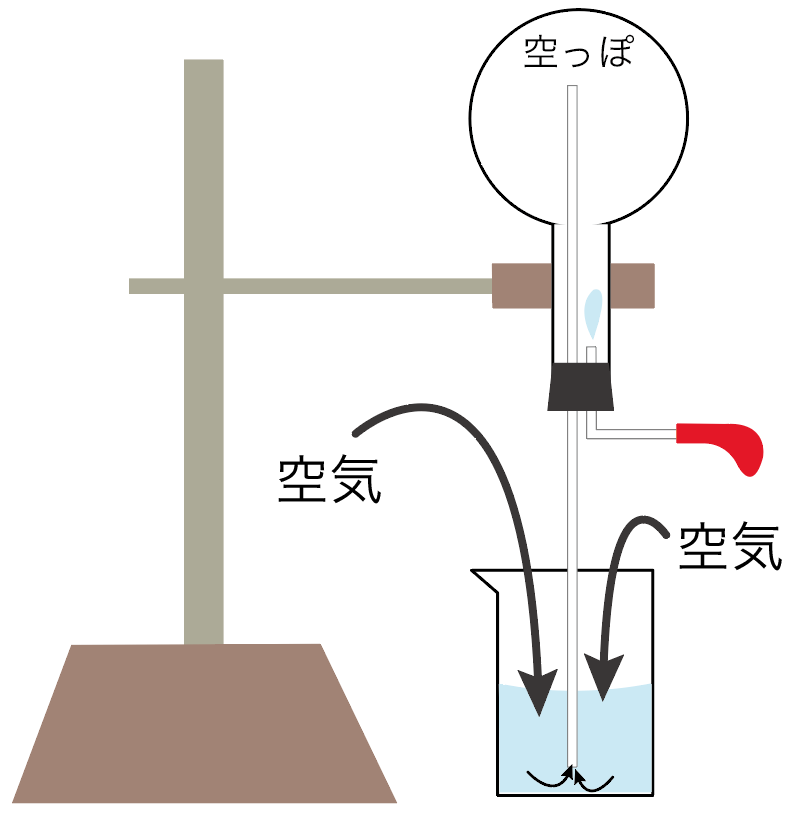
丸底フラスコの圧力が低い状況だから、ガラス管を伝って、どんどん周りの空気が入ってくる。

外から空気がガラス管経由でガンガン入ってこようとするから、フェノールフタレイン溶液が入ってる水がどんどん上に押し上げられていくのね。
吸い上げられたフェノールフタレイン溶液は、赤色に変化するよ。

なぜなら、
丸底フラスコの中には、アンモニアが溶けた水がいたからね。
スポイトでちょっと出した水は気体のアンモニアが溶けてアンモニア水になっていたんだ。
んで、アンモニア水は「アルカリ性」だから、この丸底フラスコに入るフェノールフタレインはこのアルカリ性に反応して、透明から赤色に変化するわけね。

丸底フラスコ内に十分に空気が入って、周囲の空気と同じ圧力になったら、アンモニアの噴水は終了。
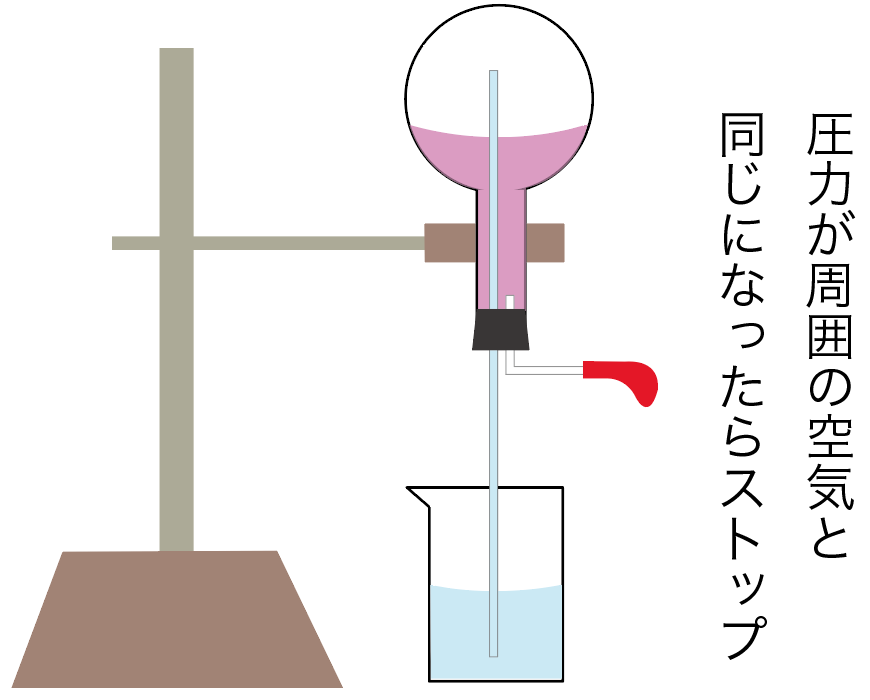
永遠にアンモニアの噴水が続くわけではないのね。
以上が、アンモニアの噴水実験のおおまかな流れだね。
最後にもう一度復習しておこう。
アンモニアの噴水実験は、
っていう実験器具たちを用意して、こんな感じでセットして行って、

アンモニアの噴水実験は、アンモニアが水に溶けやすいから、気体のアンモニアが丸底フラスコからなくなっちゃって、真空状態になるから起こる現象だったね。

テストにも出やすい実験だから、よーく復習しておこう。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。カーテンは閉めないね。
中1理科では、
の2つの言葉を勉強していくよね??
有機物と無機物は1文字しか違わないし、あやうく「有理数と無理数」と混同しそうになるぐらいややこいぜ。
しかも、有機物と無機物に限ってテストに出やすいから困っちゃうよね。
今日はそんな「有機物と無機物の違い」をわかりやすくまとめてみたよ。
よかったら参考にしてみて。
早速、有機物と無機物の違いを解説していくよ。
有機物と無機物にはズバリ、
炭素を含む物質かどうか?
っていう違いがあるよ。
炭素を含む物質を「有機物」、炭素を含まない有機物ではない物質を「無機物」ってよんでるんだ。

大雑把にいうとね。
もうちょっと詳しくみていこう。
有機物とはさっきもちらっと触れたように、
炭素を含む物質
のことだね。
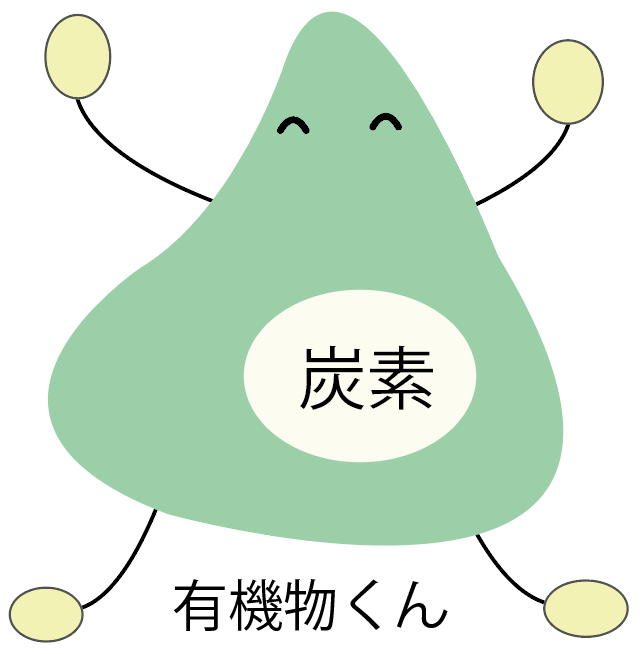
たとえば、砂糖とかジャガイモのデンプンとかが有機物だ。
こいつらはみんな炭素を含んだ物質なんだ。
だがしかし、大人の都合もあってか、
二酸化炭素、炭素、一酸化炭素は炭素を含んでるんだけど、有機物には分類されない
っていうことに注意してね。
無機物とは、
有機物では無い物質のことだ。
炭素や二酸化炭素などの有機物の仲間に入れなかった一部の例外の物質をのぞくと、
炭素を含まない物質とも言えるね。
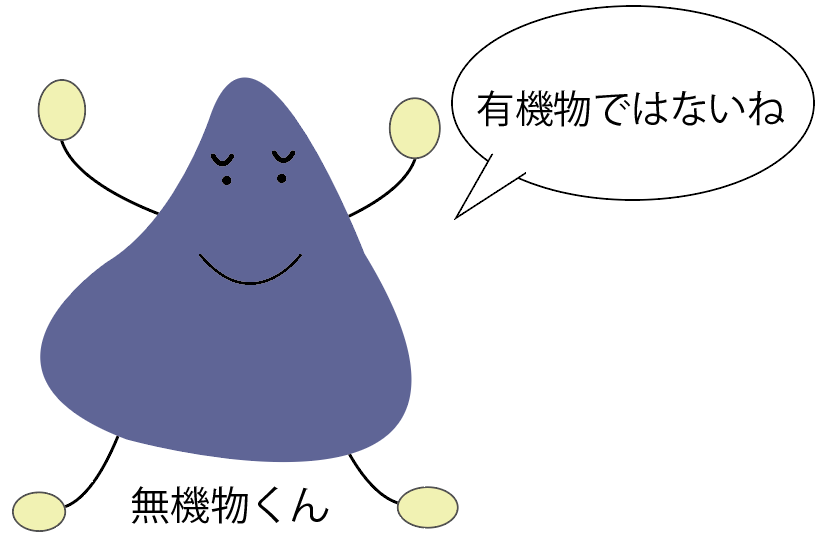
無機物の具体例としては、食塩とか金属かな。
だがしかし、有機物と無機物の違いは外見上からはよくわからないよね??
炭素を含んでるかどうかなんて、見た目からだとエスパー能力がないと判断できない。
じゃあ一体、どうやって有機物と無機物を見分けるのかというと、
加熱して反応を見る
っていう方法が一般的だ。

もし、ある物質を加熱したら、
炎を出して燃えて、二酸化炭素ができたらそいつは有機物だ。
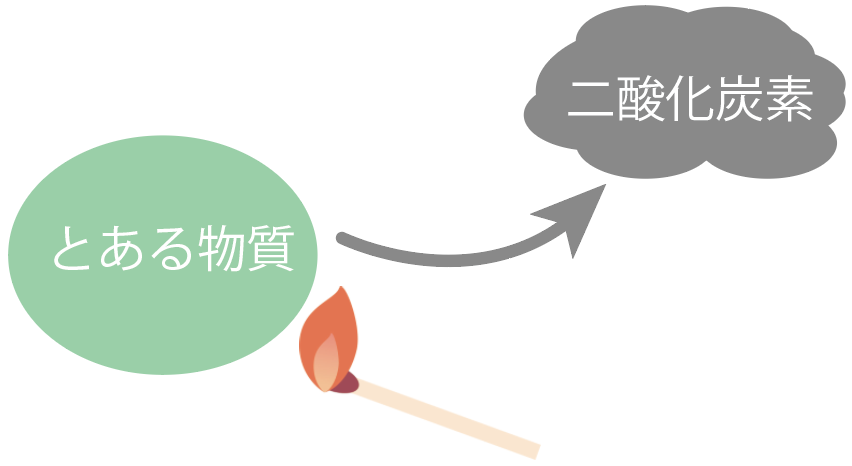
二酸化炭素ができたら、石灰水が白く濁るからすぐわかる。
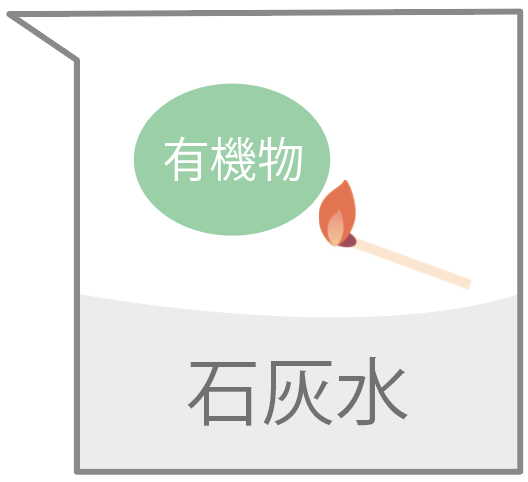
一方、燃やしても二酸化炭素が発生しない場合。
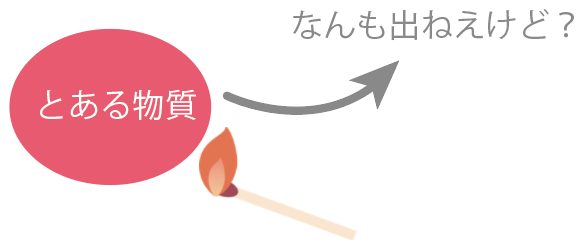
そいつは十中八九、無機物だ。
石灰水は白く濁らないはずね。
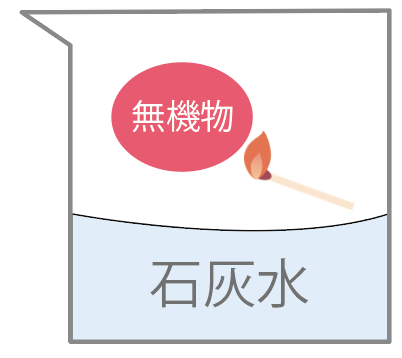
以上が、有機物と無機物の違いだったね。
最後に表にまとめておくよ。
| 炭素 | 燃やすと? | |
|---|---|---|
| 有機物 | あり(二酸化炭素、炭素は例外) | 二酸化炭素でる |
| 無機物 | なし | 二酸化炭素でない |
有機物と無機物は見た目では見分けられないから、ガスバーナーで加熱して反応を観察してみよう!
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。握りつぶしたいね。
中学生の理科の実験でいちばん使う実験器具。
それは、
ガスバーナー
だ。
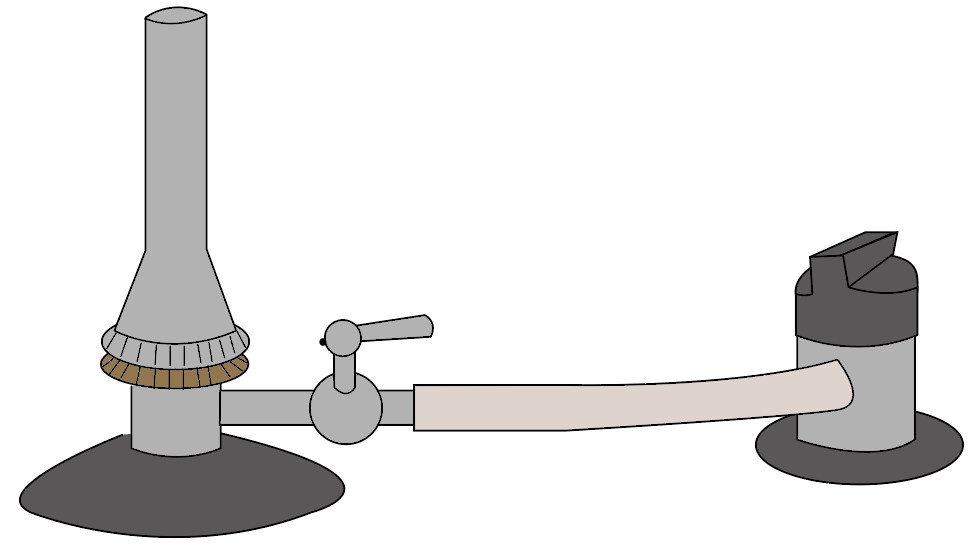
ガスバーナーは一言で言ってしまうと、
ガスを使って火をつける道具のことだったね。

使い方は、
ガスを流して、マッチで点火して、空気をガスに混ぜて炎を安定化する
っていう感じだ。
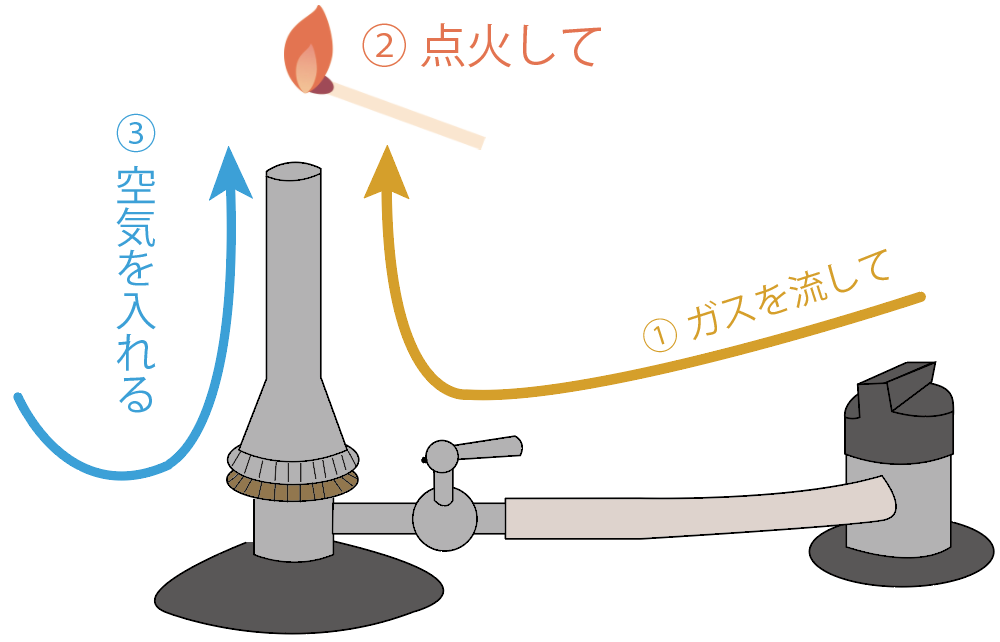
今日はもう一歩踏み込んで、ガスバーナーの使い方を詳しく、
の3つのステップの使い方をそれぞれ詳しくみていこう。
まずはガスバーナーの使い方の第一ステップだ。
このフェーズでは、ガスバーナーで火をつけていく方法を勉強していくよ。
まずは、事前の安全チェック。
ここでは、ガスバーナーの2つのねじである、
の2つがしっかり閉まっているか確認してみよう。
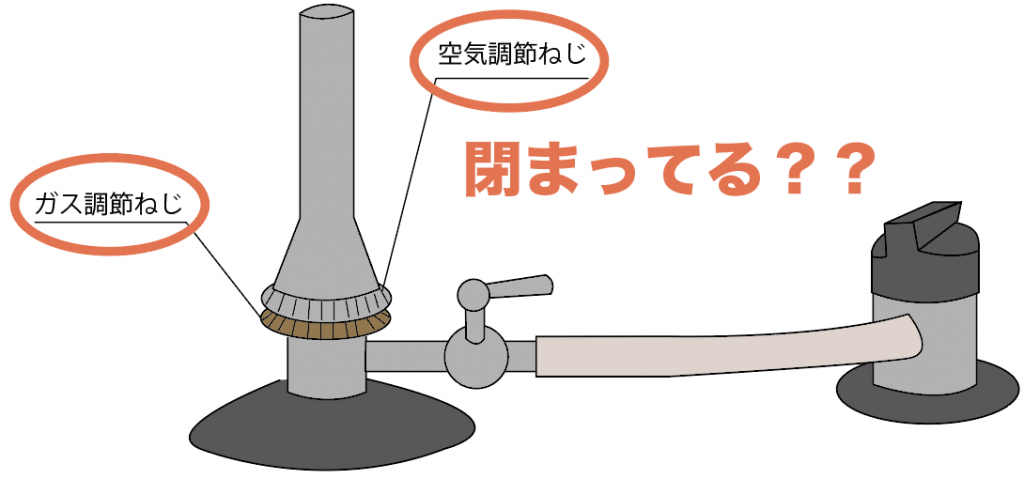
なぜチェックしなきゃいけないのか??
それはズバリ、ガス漏れを防ぐためだね。
たとえば、2つのネジを締めてないとしよう。
この状態で、元栓とコックを開けちゃうと、開けた時点から周囲にガスが蔓延しちゃうことになるね。
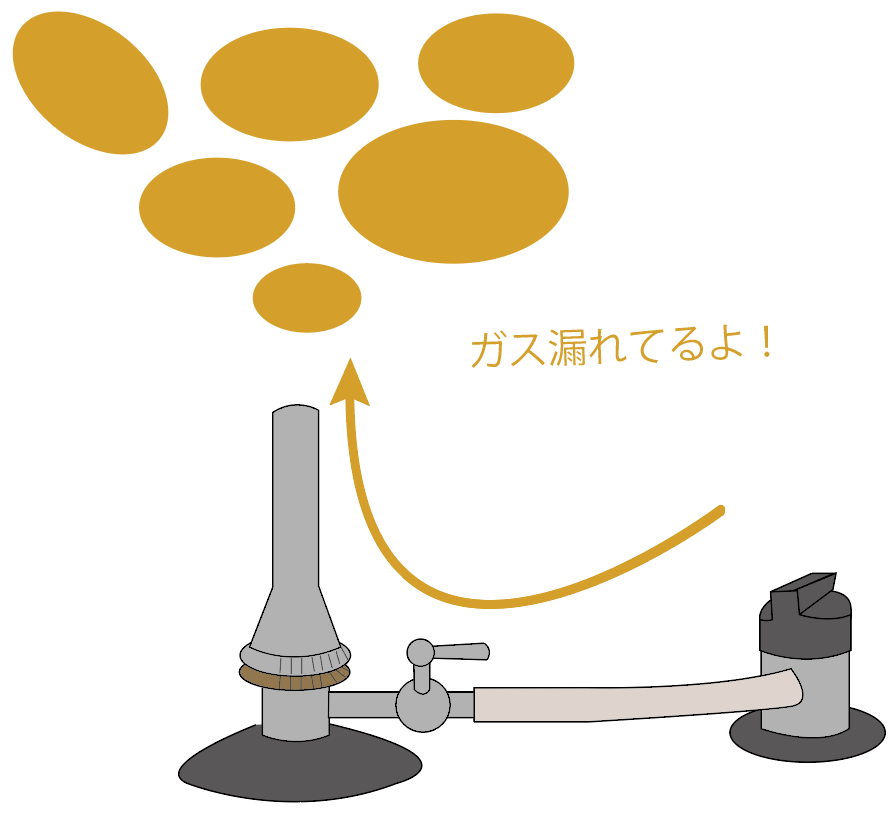
この時点で、マッチに火をつけると、自分が把握していないところを漂っているガスに火が着火してしまうかもしれないから危ないんだ。
だから、必ずガスバーナーを使う前は、
ガスを最後にガスを引き留めることになる「ガス調節ねじ」と、
ガスの火を強化する「空気調節ねじ」はしまっていることを確認してから始めよう。
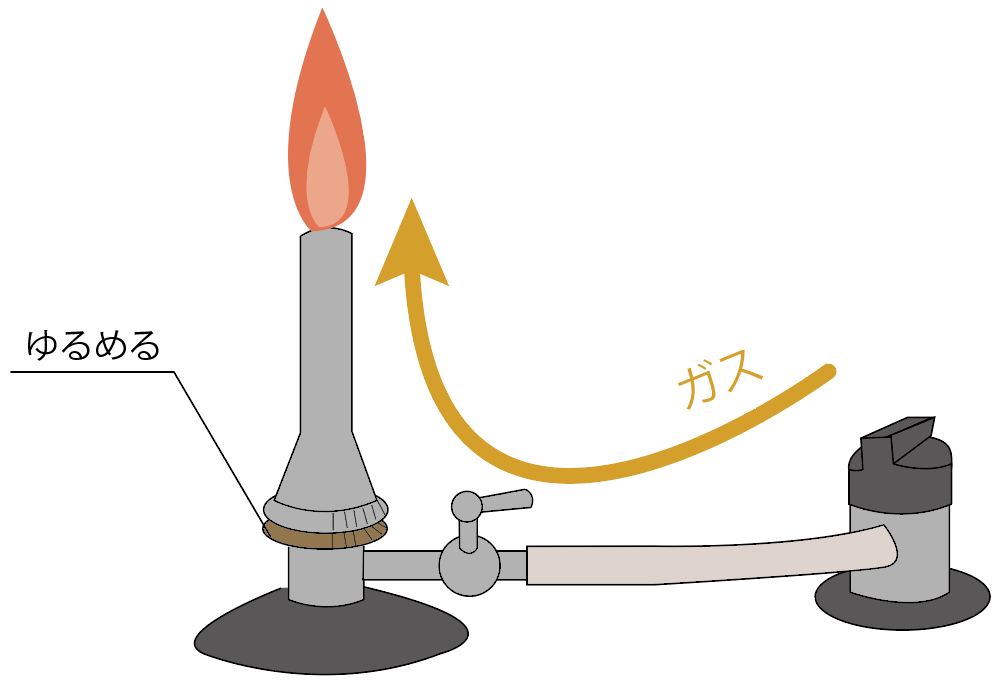
続いては、ガスバーナーの元栓を開けてみよう。
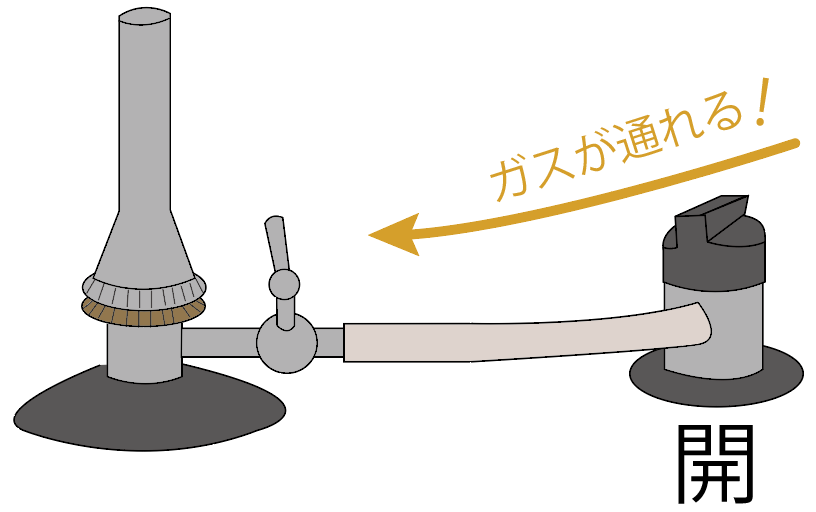
元栓を開けると、コックの手前までガスが流れてくるはず。
ガスバーナーのコックを開けよう。
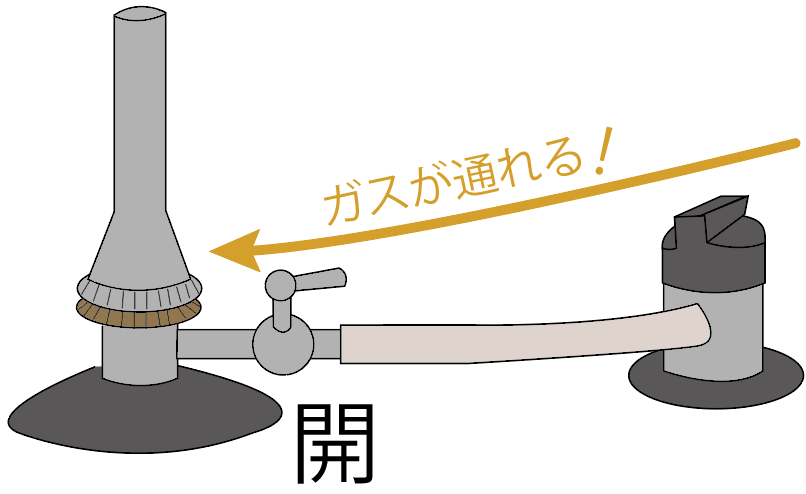
すると、ガス調節ねじの手前までガスが来てるはず。
次に、マッチで火をつけてガスバーナーの口の近くに近づけてみよう。
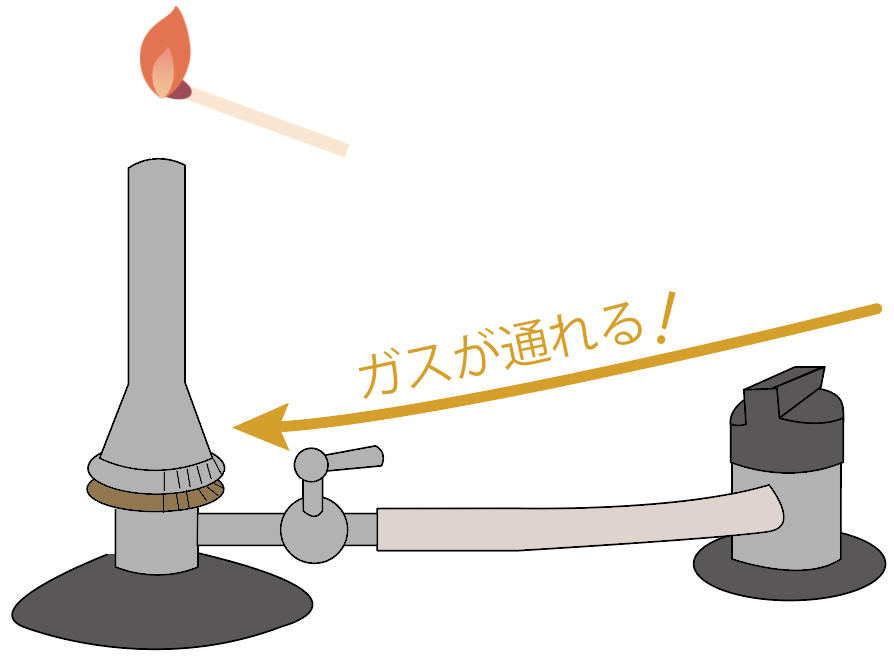
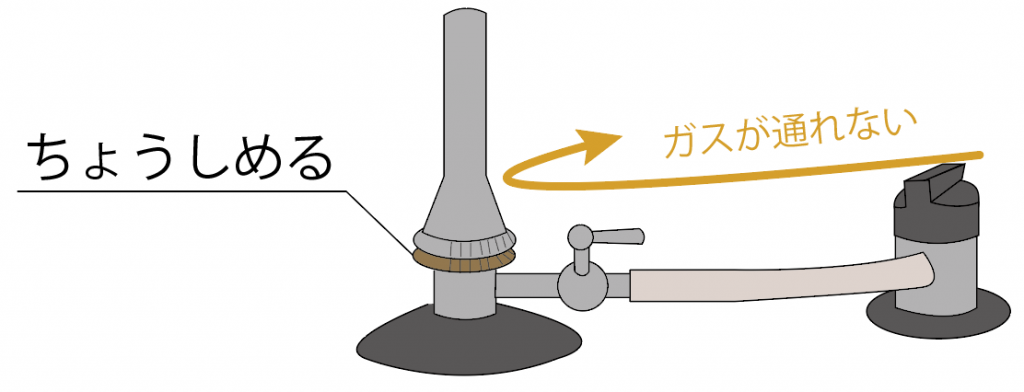
ガス調節ねじをゆるめよう。少しずつね。
すると、ガスがガス調節ねじより先に進むことになる。
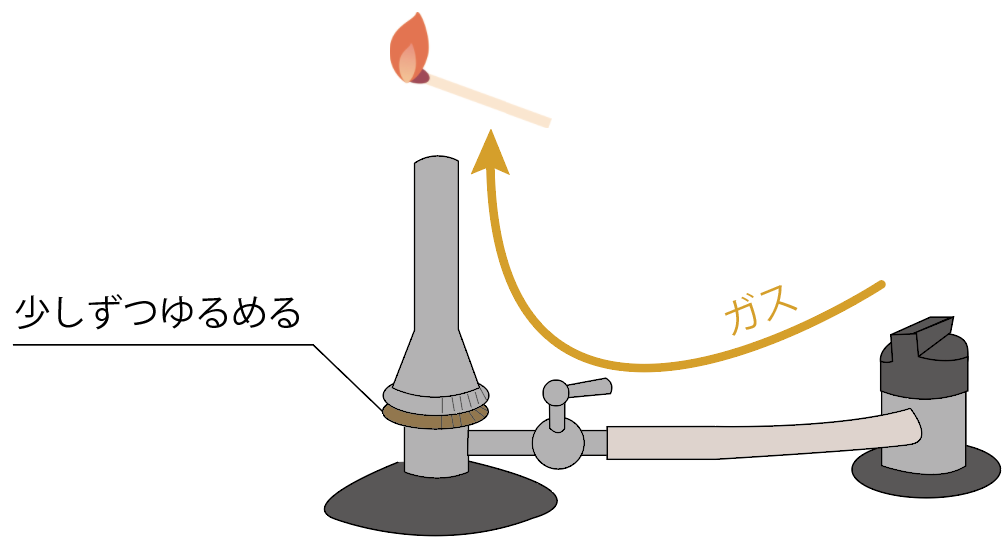
うまくいけば、マッチの火でガスバーナーに炎がつくね。
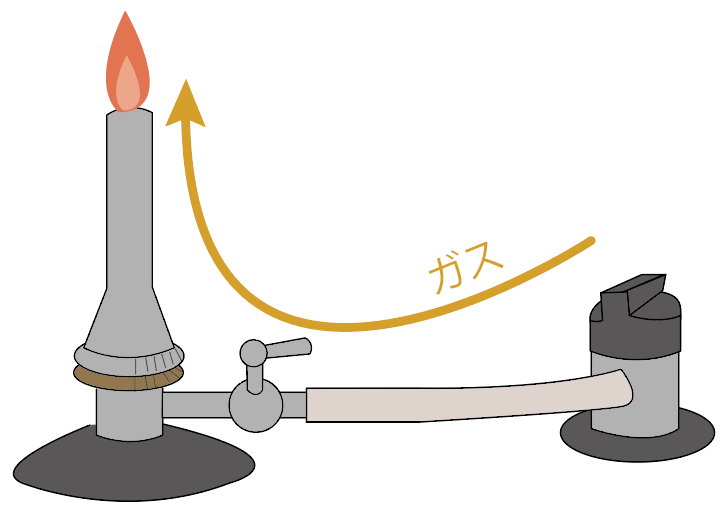
さて、ガスバーナーに灯した火を調整していくよ。
ここでは主に、
の2つを調整していくんだ。
まずはガスの量を「ガス調節ねじ」を使って調整してみよう。
ガス調節ネジをしめれば、ガスの量が少なくなるから炎は小さくなるね。
逆に、ガス調節ねじをゆるめていけば、ガスの量が多くなるから、ガスバーナーの炎は大きくなるよ。
次は、ガスに混ぜる空気の量の調整ね。
空気の量の調整には「空気調節ねじ」を回すんだったね?
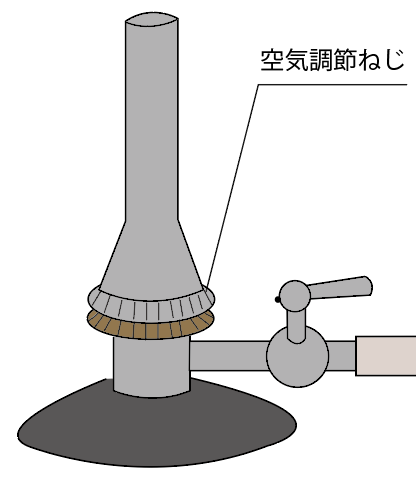
「ガス調節ねじ」が一緒に回らないように抑えながら、「空気調節ねじ」をゆるめていこう。
空気の量が十分ガスに混じると、炎の色が青色に変化するはず。
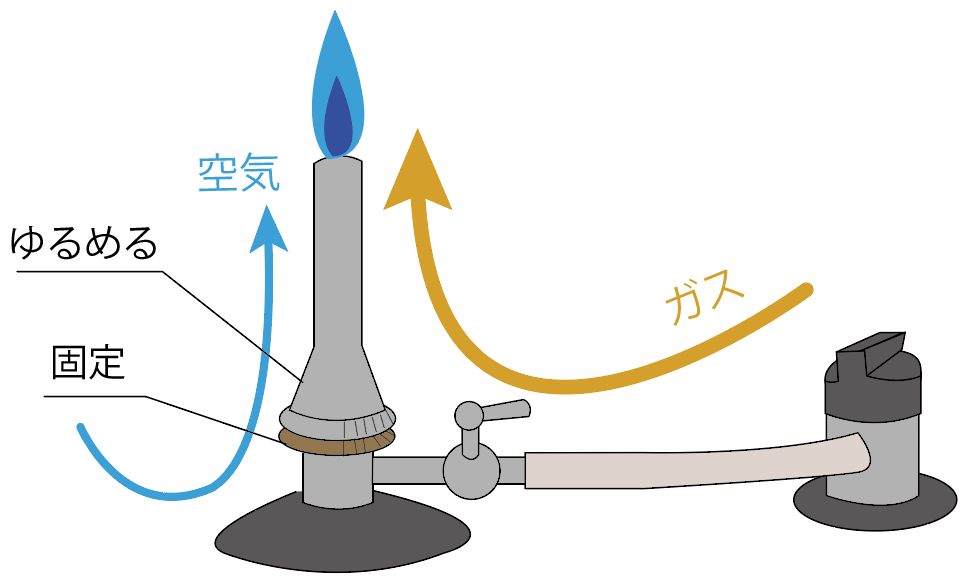
これは空気の酸素がガスに混じって、火が完全燃焼できている証拠。
この状態でものを熱すると、ススがつかないできれいにガスバーナーの炎を使うことができるんだ。
空気が足りないとオレンジの炎になっちゃうし、

空気を入れすぎると、ごおごおと音がなっているはず。
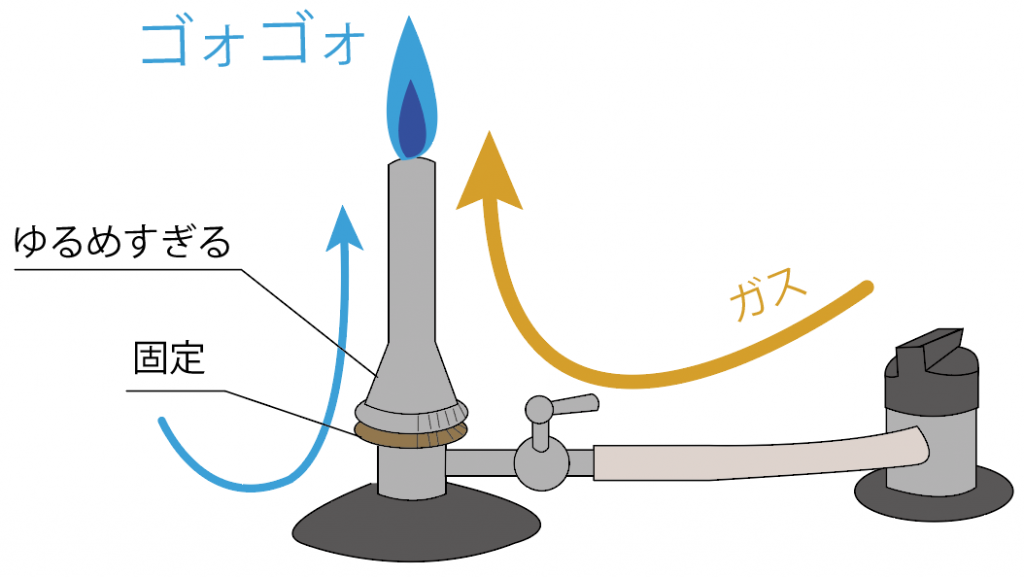
空気調節ねじを回して、丁度いい量の空気をガスに送り込んでやろう。

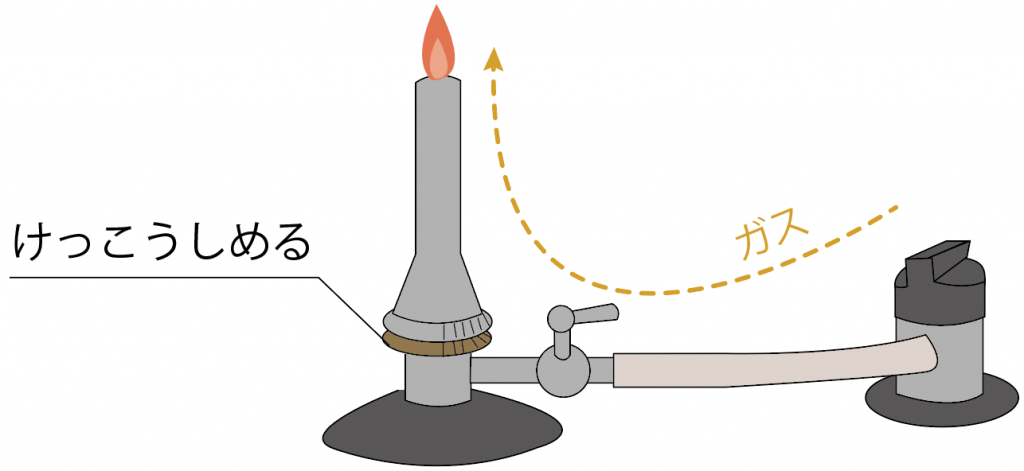
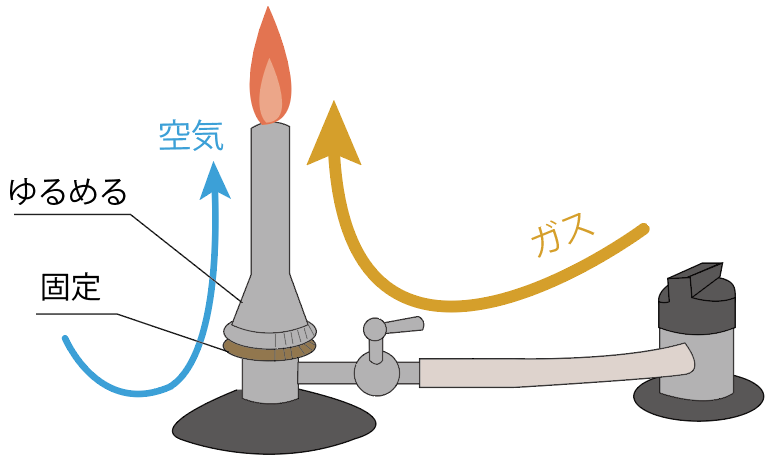
最後はせっかくつけたガスバーナーの炎を消しにかかるよ。
消し方はいたって簡単。
炎に近いところから徐々に元に戻していけばいいんだ。
一番炎に近い「空気調節ねじ」をしめてやろう。
すると、炎の色が青色からオレンジ色に戻るはずだ。
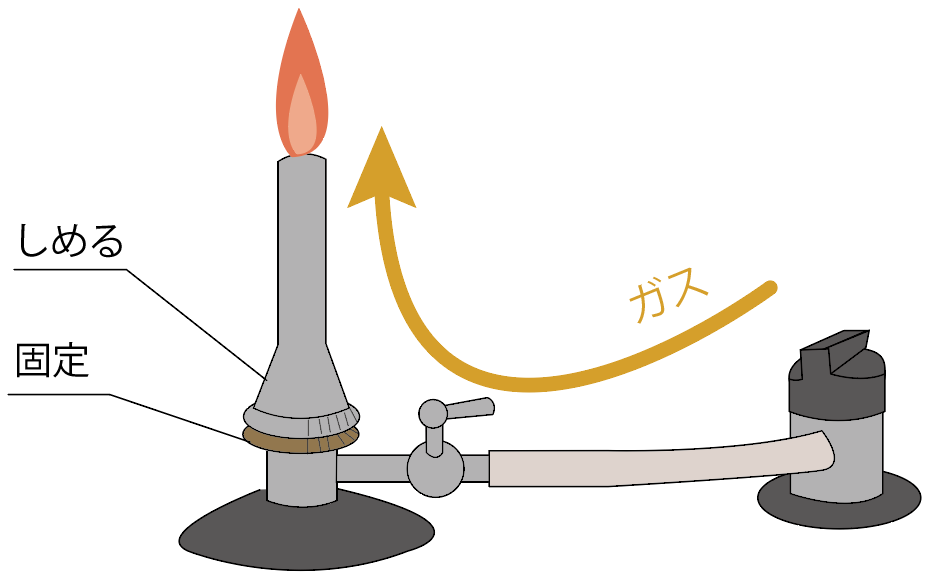
次は、ガス調節ねじをしめる。
すると、「ガス調節ねじ」より内側にガスが封じ込められるから、火が消えるはずだね。
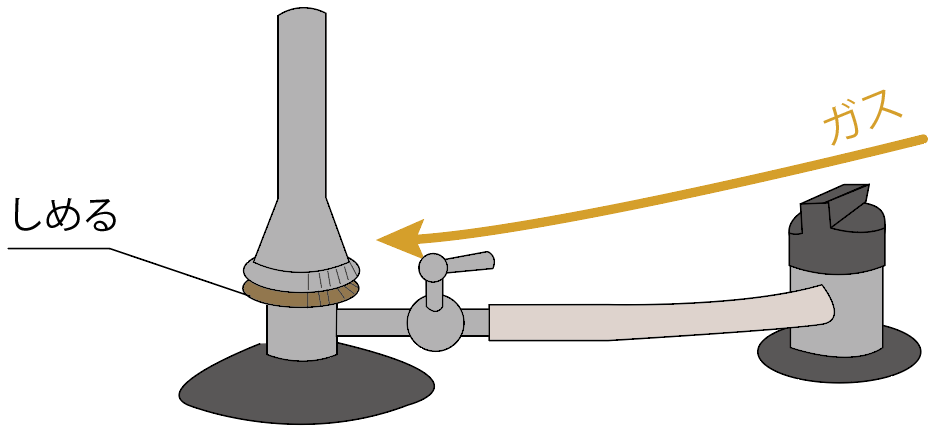
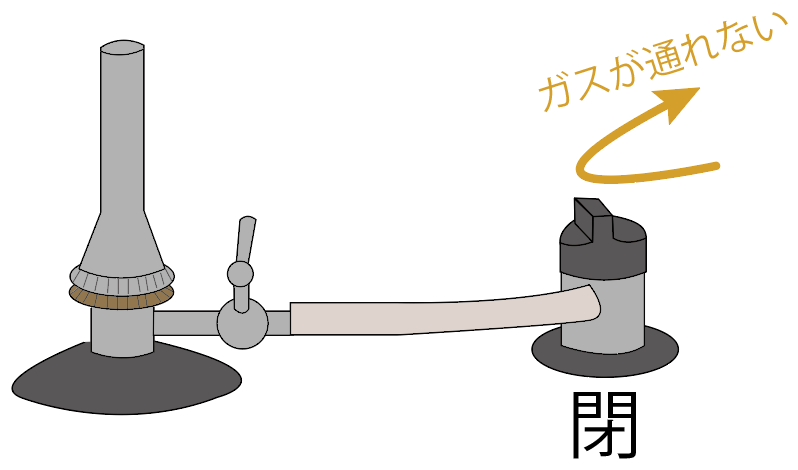
コックを閉じよう。
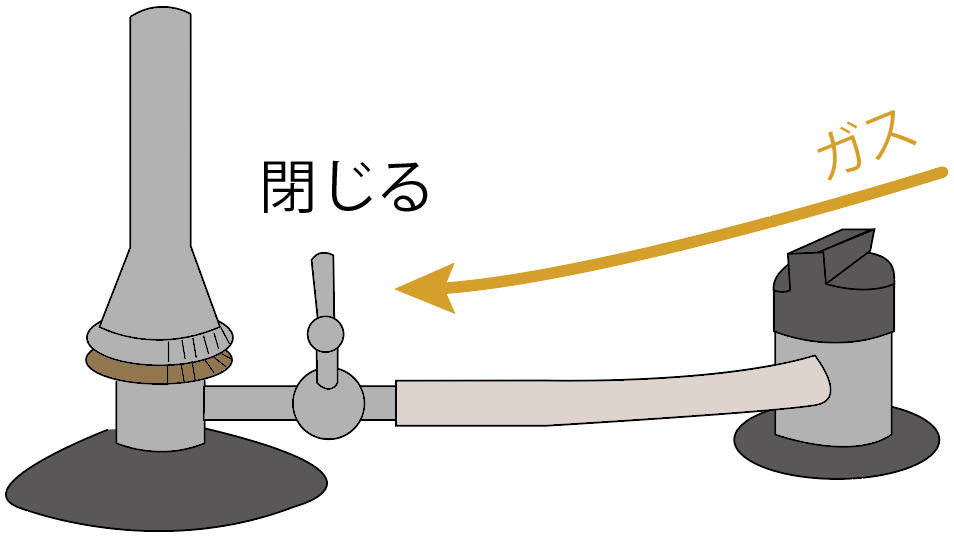
元栓を閉じよう。
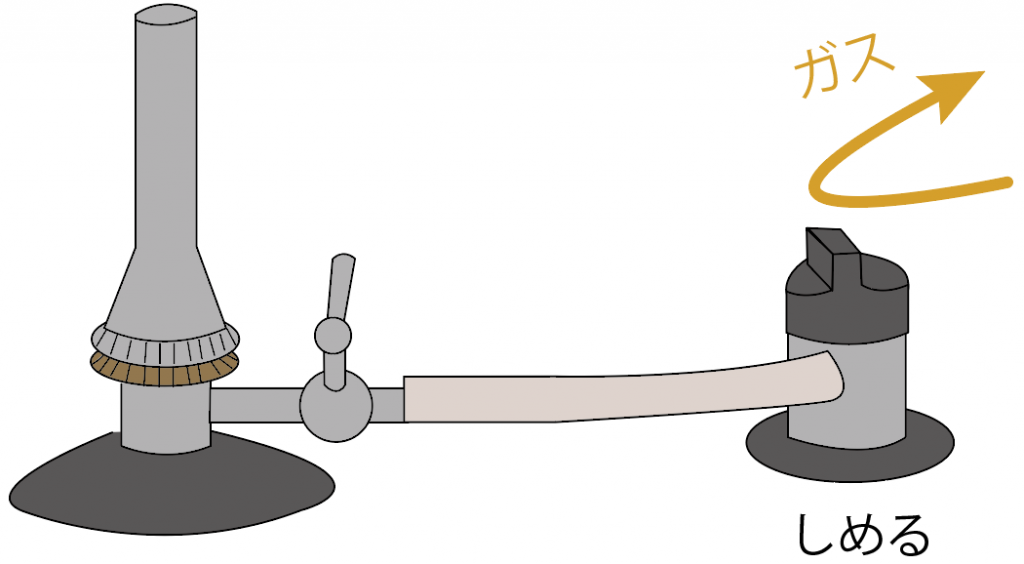
これでガスの流れを元栓で食い止めてられてるはず。
事故の心配もなしだ。
以上が、ガスバーナーの使い方だ。
理科の授業では使い方を習うけど、やってることは次の3つ。

厄介なことに、このガスバーナーの使い方はテストで狙われやすい。。
テスト前によーく復習しておこう。
そんじゃねー
Ken
こんにちは!この記事を書いているKenだよ。カフェインで生きてるね。
中学1年生の理科ではいろんな実験器具を使っていくよね。
とかここまで使い方を勉強してきたけど、今日はもう一つ新しい実験器具が登場するよ。
その名も、
ガスバーナー
だ。

これは一言で言うと、
ガスを使って火をつける装置だ。

ガスをガスバーナーに流して、マッチで点火して、空気を入れて炎を安定化させて使っていくんだ。

早速、ガスバーナーの使い方を解説していきたいところだけど、今日はちょっとその下準備。
その前に知っておきたい、
ガスバーナーのパーツの名称と役割を勉強していこうね。
テストに出やすいガスバーナーの名称と役割を紹介していくよ。
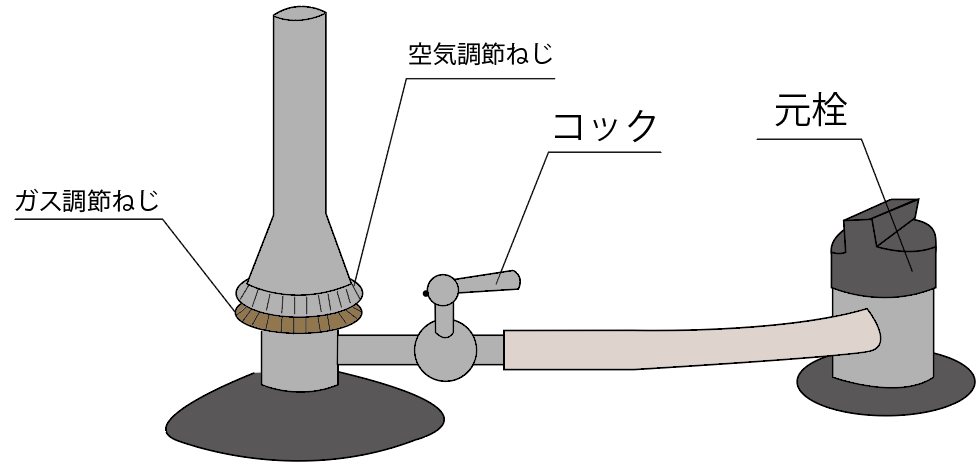
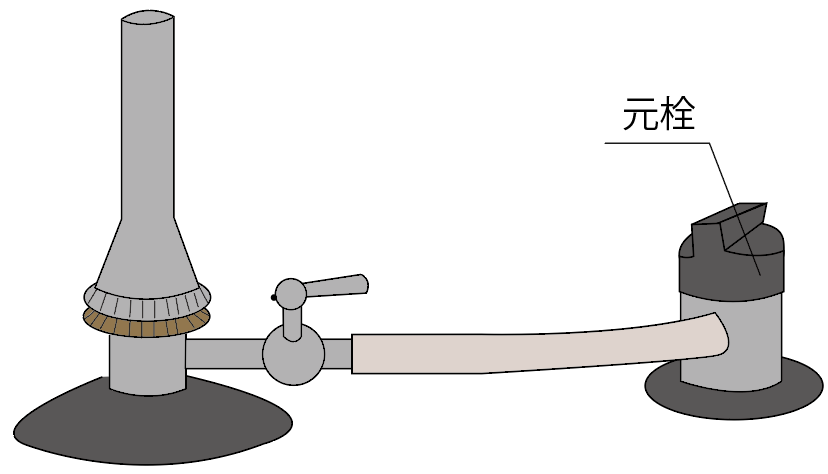
まず一つ目のガスバーナーの名称は、
元栓(もとせん)
だ。
こいつは何をやっているかというと、
ガスの流れをコントロールしているんだ。
元栓を閉めると、元栓より先にガスが進まなくなっているし、
元栓を開くと、ガスを通すことができるんだよ。

いわば、関所の番人みたいなやつだ。
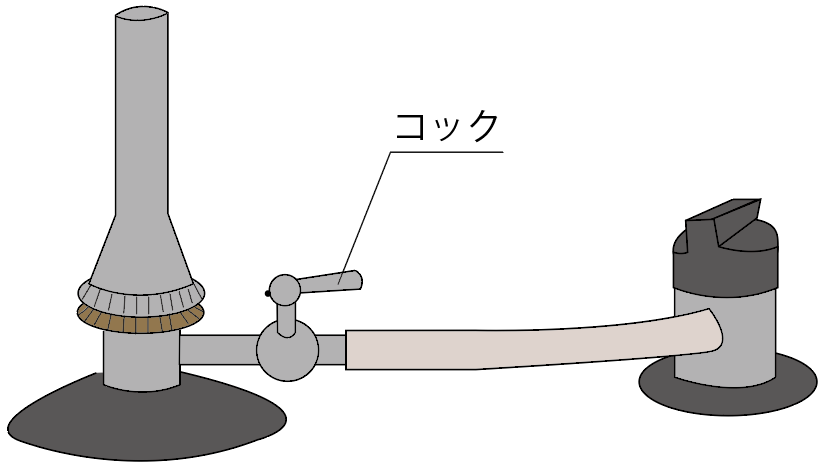
2つ目の名称は、
コック
だ。
これは料理人のコック(cook)ではなく、蛇口とか栓の意味のコック(cock)のことね。
こいつも元栓と役割は一緒。
ガスの流れをコントロールしているんだ。
コックを閉めると、コックより先にガスは流れないし、
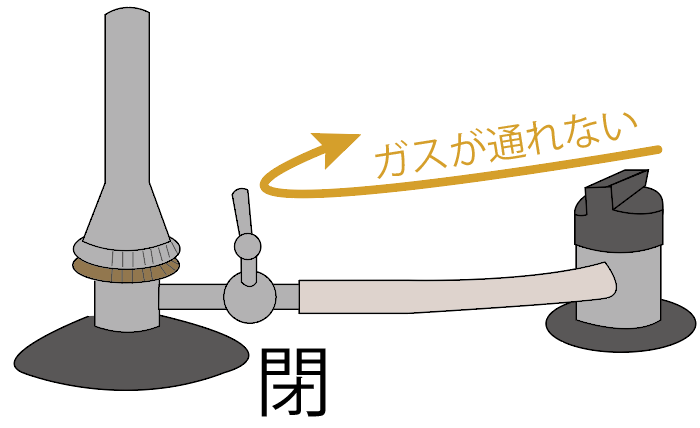
コックを開けると、コックより先にガスが進んでっちゃう。

元栓よりもガスバーナー側に近い位置にある栓。
ガスを通すか通さないか決める、第二の関門みたいな感じだね。
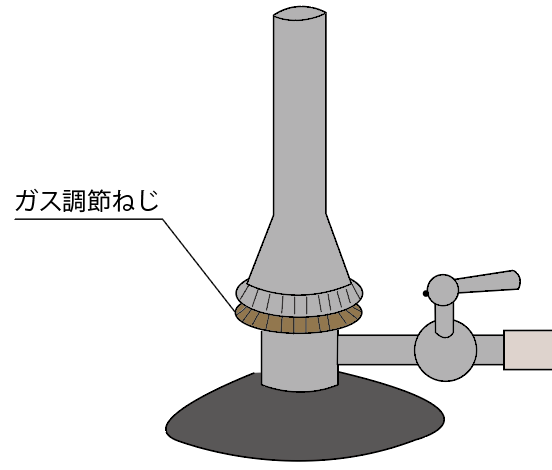
3つ目のガスバーナーのパーツの名称は、
ガス調節ねじ
だ。
元栓・コックと同じで、ガスの流れをコントロールしてるんだけど、もっと進んで、
ガスを流す量をコントロールできるパーツなんだ。
しめまくれば、ガスはねじより先はガスが流れなくなるし、
ちょっとでも緩めればガスは流れ出す。
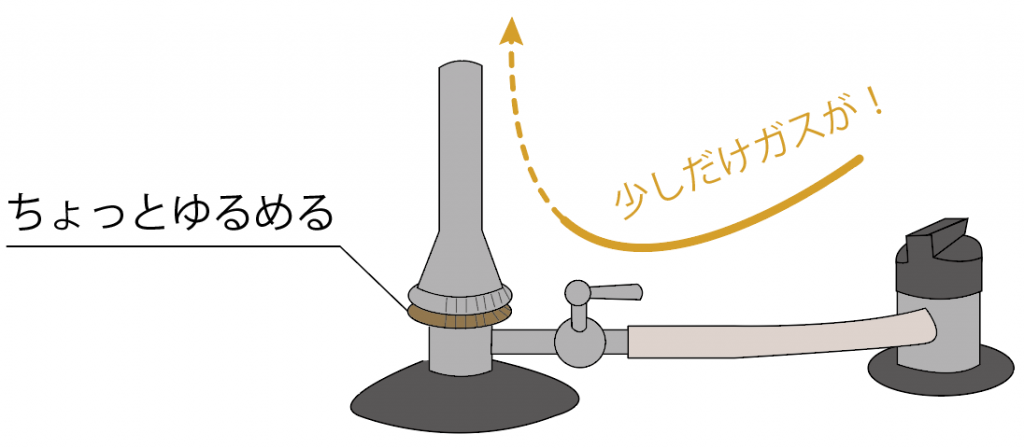
しかも、どれくらいのガスを流すかの量が決められるから、ガス調節ねじを緩めまくると、ガスの量が増えて火が強くなるんだ。
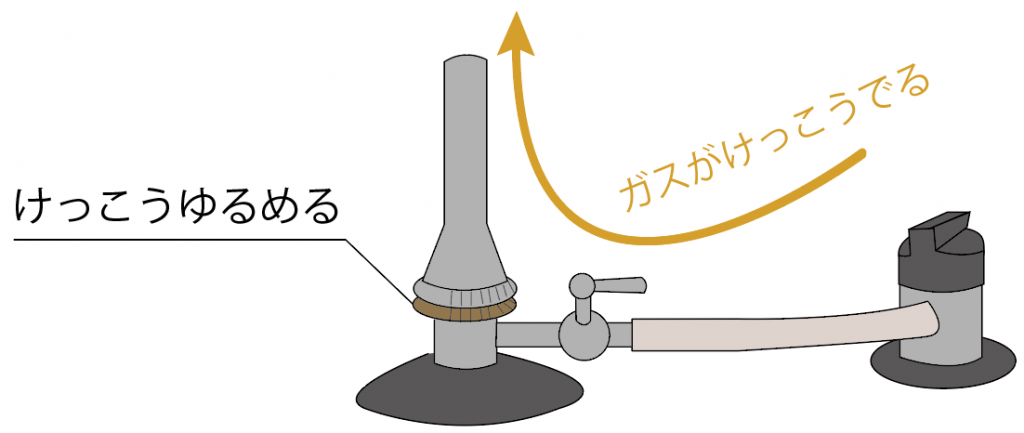
こんな感じで、ガス調節ねじでは、
っていう2つの役割があるわけね。
関所と司令塔が合体したようなもんだ。

最後のガスバーナーのパーツの名前は、
空気調節ねじ
だ。
このパーツの役割は簡単で、
ガスに混ぜる空気の量をコントロールするパーツだ。
開きまくれば、大量の空気がガスに混じることになるし、
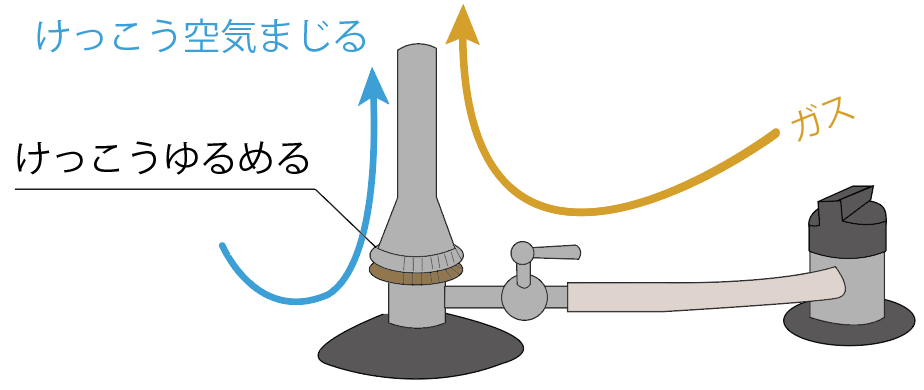
ぎゅうぎゅうに締めれば空気がガスに混じらなくなる。
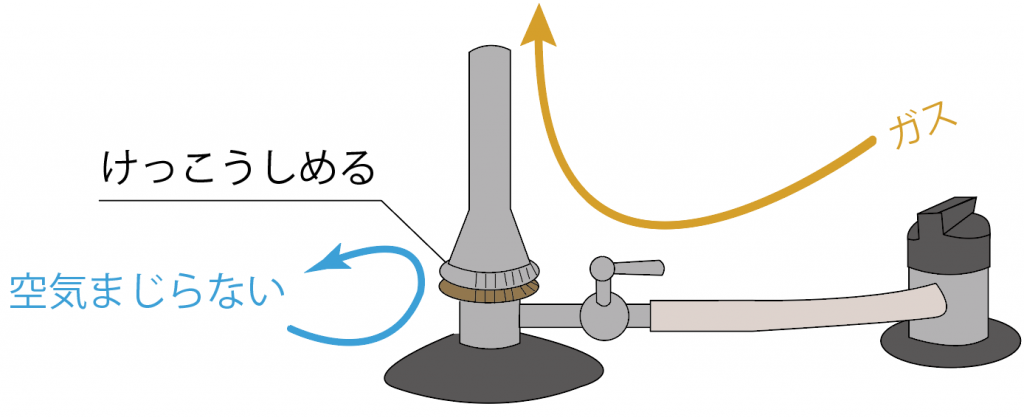
ガスに空気を混ぜてガスバーナーの炎を安定するときに活躍するパーツだね。
ここまでのパーツは主に、ガスの流れをコントロールする奴らばかりだったけど、空気調節ねじは一味違う。
ガスに空気を混ぜて、ガスをドレスアップするメイクアップさんみたいなパーツだ。
と、以上がガスバーナーの名称と役割だったね。
せっかくだから、最後に簡単に復習しておこう。
元栓は、ガスの流れをコントロール(通すか通さないか)していて、

コックも元栓と同じく、ガスの流れをコントロール(通すか通さないか)という役割があって、

「ガス調節ねじ」は、ガスの量をコントロール(どれくらい?)していて、

「空気調節ねじ」はガスに混ぜる空気の量をコントロール(炎を安定化)しているんだったね。

次回はいよいよガスバーナーの使い方を解説していくよ。
そんじゃねー
Ken
こんにちは!この記事を書いてるKenだよ。湯気出てるね。
中1理科の実験や観察では、いろんな実験器具を使うことになっていくよ。
実験器具の使い方を知っているとモテるのはいうまでもないけど、何と言っても、
実験器具の使い方はなぜかテストに出やすいんだ。
その中でも今日は、テストに出やすくて実験でよく使う、
電子てんびんの使い方
を解説していくよ。
電子天秤とは簡単にいってしまうと、
「もの」の質量をはかる道具
だ。
使い方はシンプルで、電子天秤(てんびん)の上に質量をはかりたいものを置いて、
ディスプレイの数値を読むだけ。
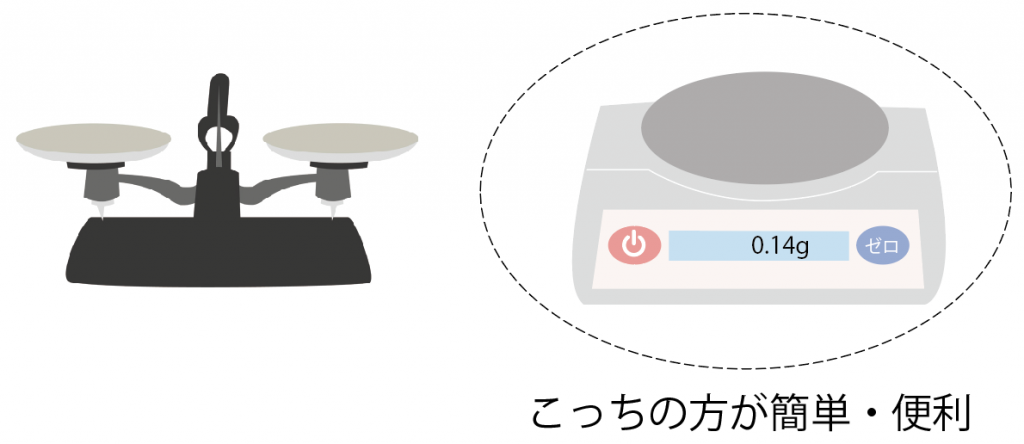
だから、「電子てんびん」は遠い昔から使われてきた「上皿天秤」と比べて使い方がむちゃくちゃ簡単。
みんなこっちの電子てんびんを使うようになってきたのさ。
この電子てんびんの使い方には次の2つの使い方があるんだ。
それぞれ順番に見ていこう。
一つ目の電子天秤(てんびん)の使い方は、
重さが不明の物の質量をはかりたいときだ。
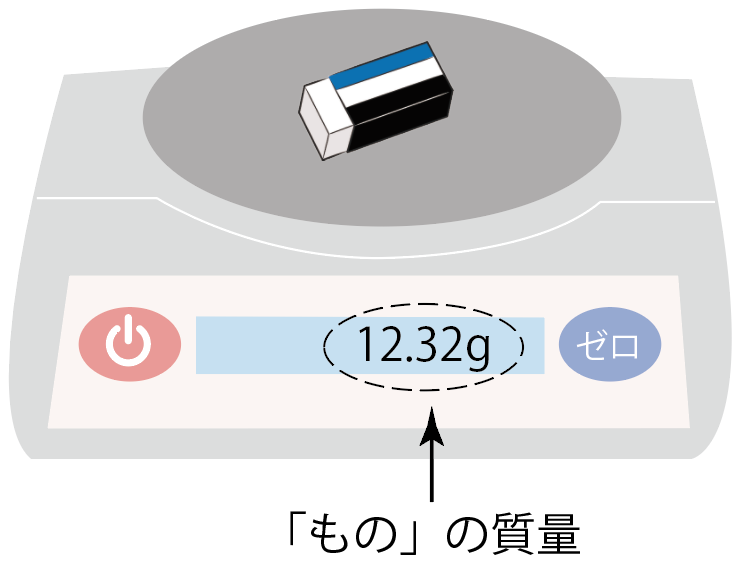
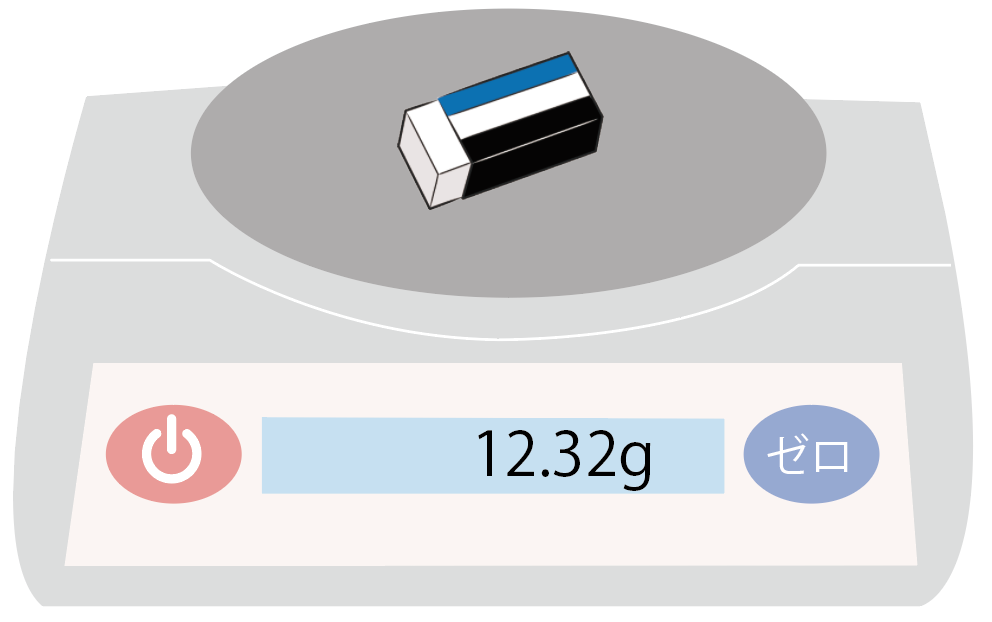
たとえば、さっきの例でいうと、この消しゴム。

「こいつは一体何グラムなのか?」
って多分時々きになる時があるよね。
お重さがわからない時に、この電子天秤を使えば質量をすぐにはかることができるんだ。
この場合の、電子てんびんの使い方は次の5つのステップを踏めば大丈夫。
まずは電子てんびんを水平な場所におこう。

電子てんびんは使っていないときはスリープ状態。
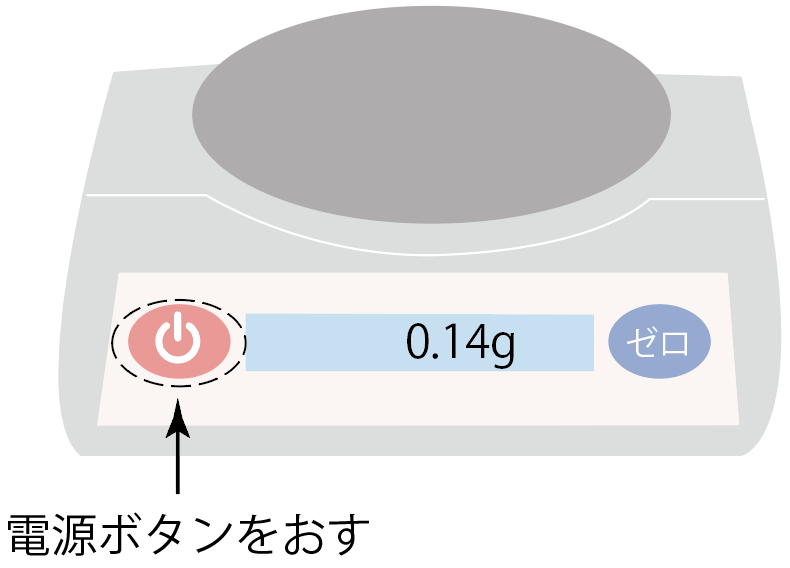
電子てんびんに備わっている電源ボタンを押して、電子てんびんを目覚めさせよう。
一旦電子てんびんのメモリを0gにリセット。
何が乗ってようがどんな表示になっていようがゼロにできるボタン「ゼロリセット」を押してみて。
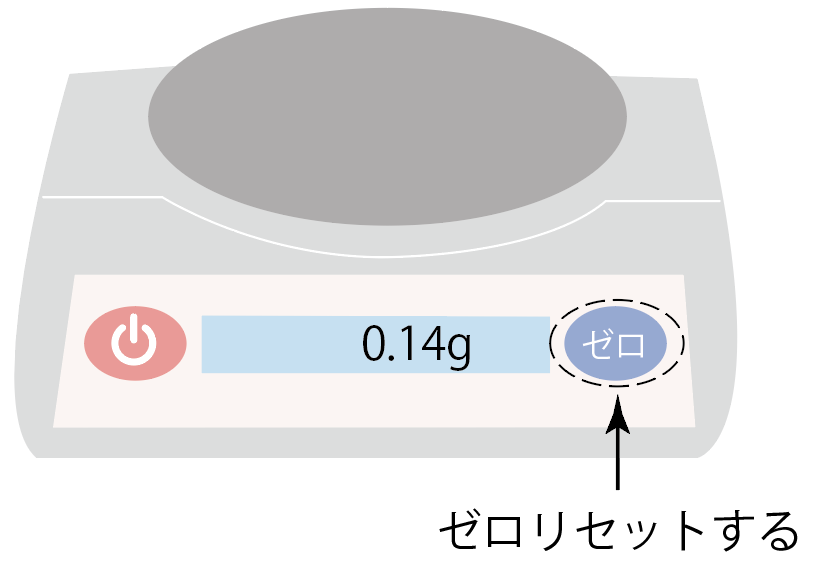
このボタンを押すことで、電子てんびんに何も乗っていない場合の表示を0にするんだ。
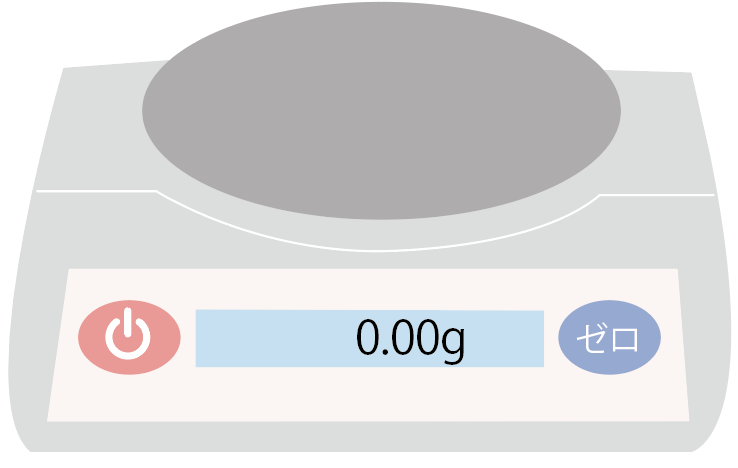
もし、何も載せてなくても0g以上の重さがあると、本当に正確な質量がはかれなくなっちゃうからね。
誰だって最初から10kgって表示されている体重計にはのりたくないじゃん?
自分の体重に10kgプラスされた体重が表示されるからね。
それと一緒だ。
いよいよ、質量をはかりたいものを電子天秤にのせてみよう。

そっとね。
あとは、電子天秤のディスプレイに表示された数字を読み取るだけ。

さっきの消しゴムの場合でいうと、
12.32 [g]
っていう質量を持つことがわかったね。
2つ目の電子てんびんの使い方は、
あるものを必要な質量の分だけ取り出したいときだ。
たとえば、薬品を必要なグラム数だけ取り出したい時に使うことが多いかな。
例として、黒豆きな粉を5.5g、電子てんびんで取り出してみよう。
電子てんびんは水平な場所へ設置!

電子てんびんの目を覚ませよう!
電源ボタンをプッシュ。

薬品などの粉末をのせるための紙、通称「薬包紙」。
こいつをまずは電子天秤の上に置いてみよう。
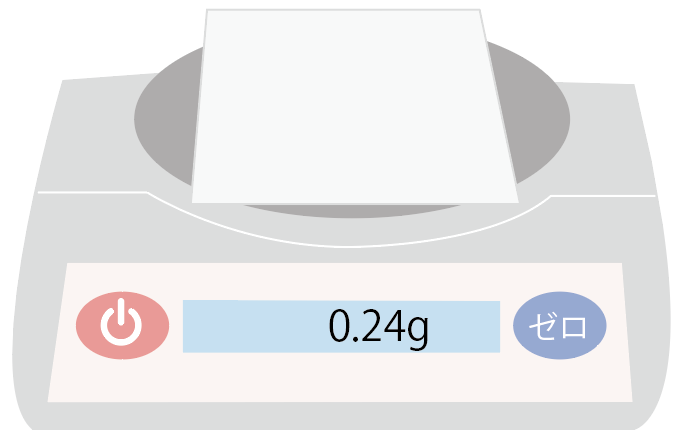
薬包紙をのせた後に、ゼロリセットボタンを押して表示を0gに。
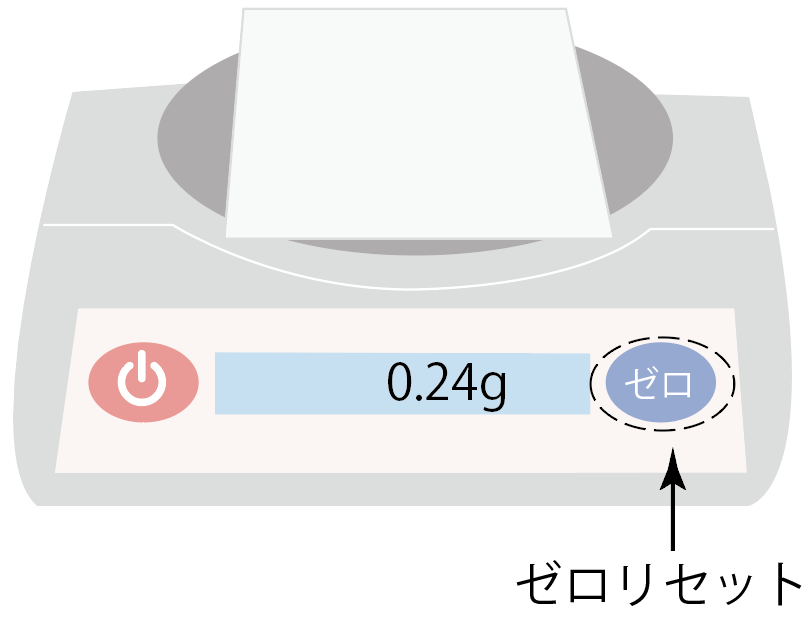
薬包紙を載せた状態でも0gになったから、薬包紙の重さを気にしないで質量を計測できるね。
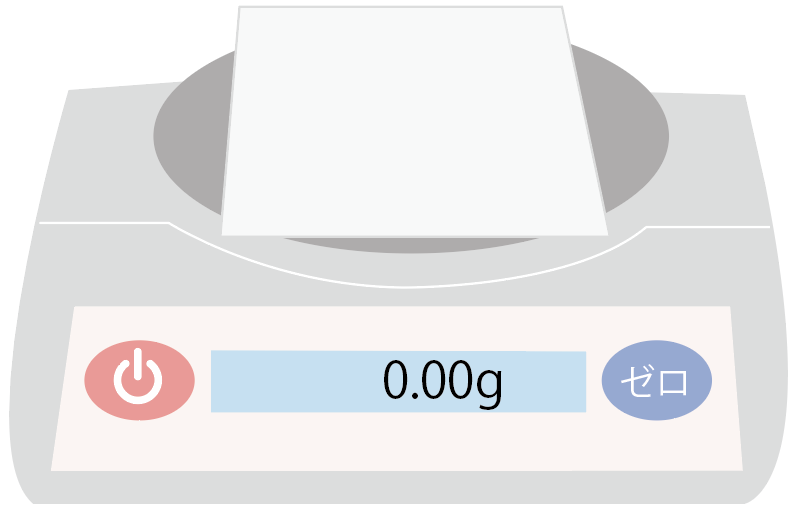
薬包紙の準備はできたね??
あとは、薬包紙の上に薬品とか粉末をのせるだけ。
今回はきな粉を5.5g取り出したいから、きな粉を薬包紙の上にのせていこう。
少しずつ載せていって、徐々に5.5gに近づけていくよ。
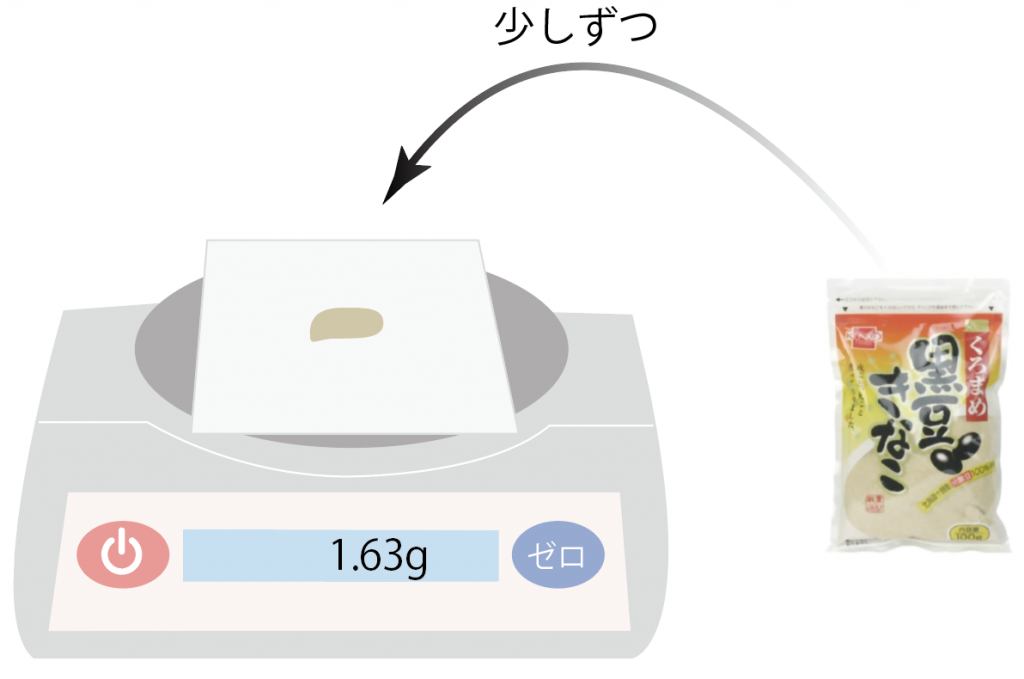
ういっす、
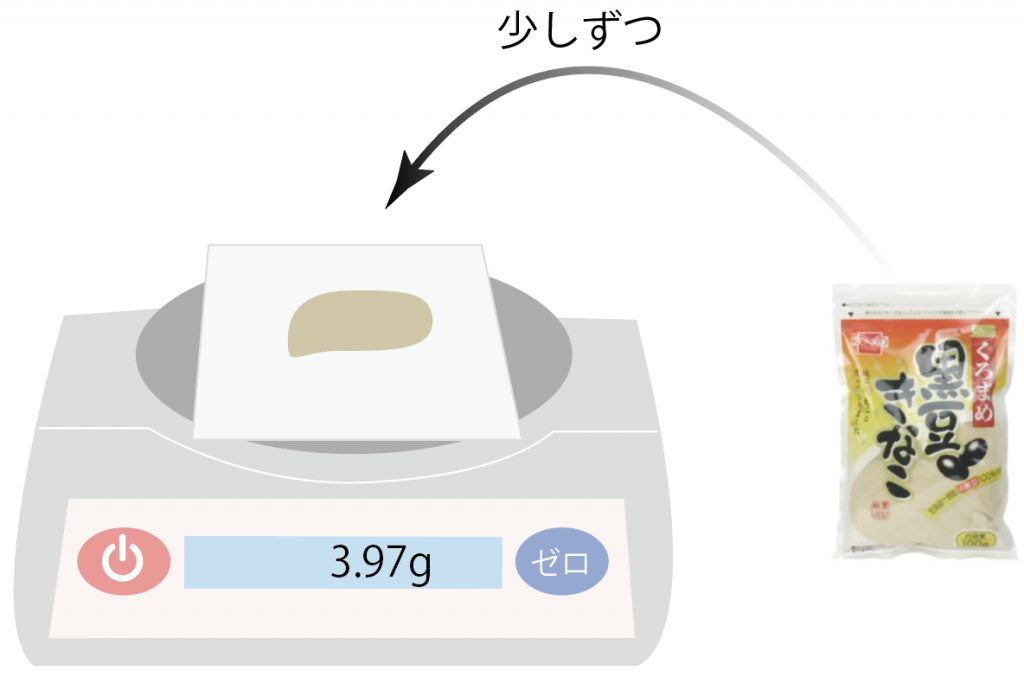
いよっと、
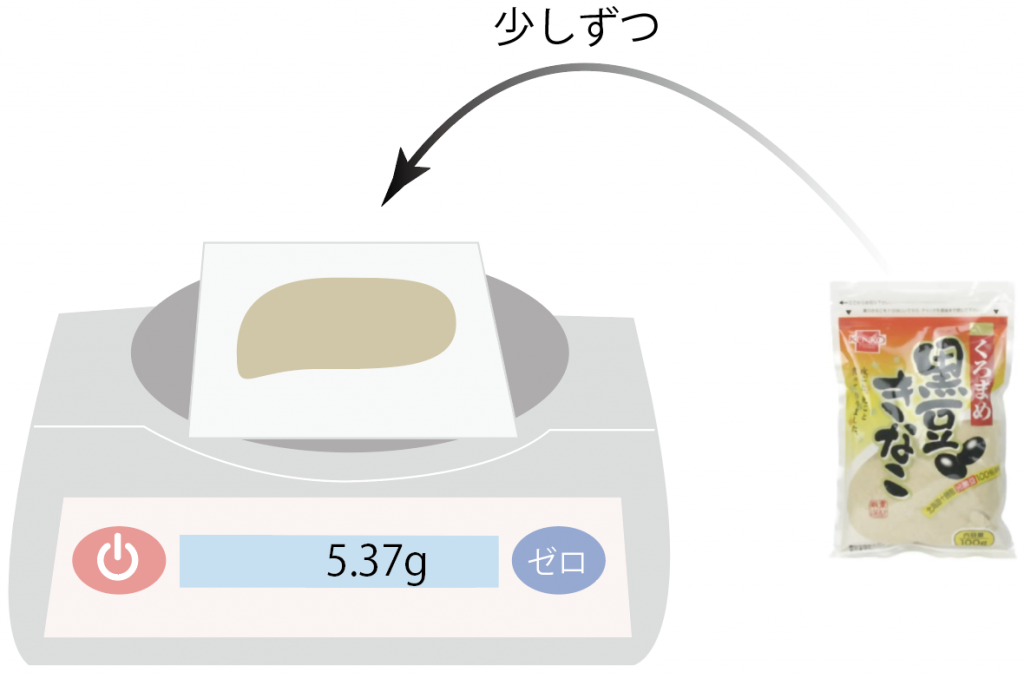
あと少し。
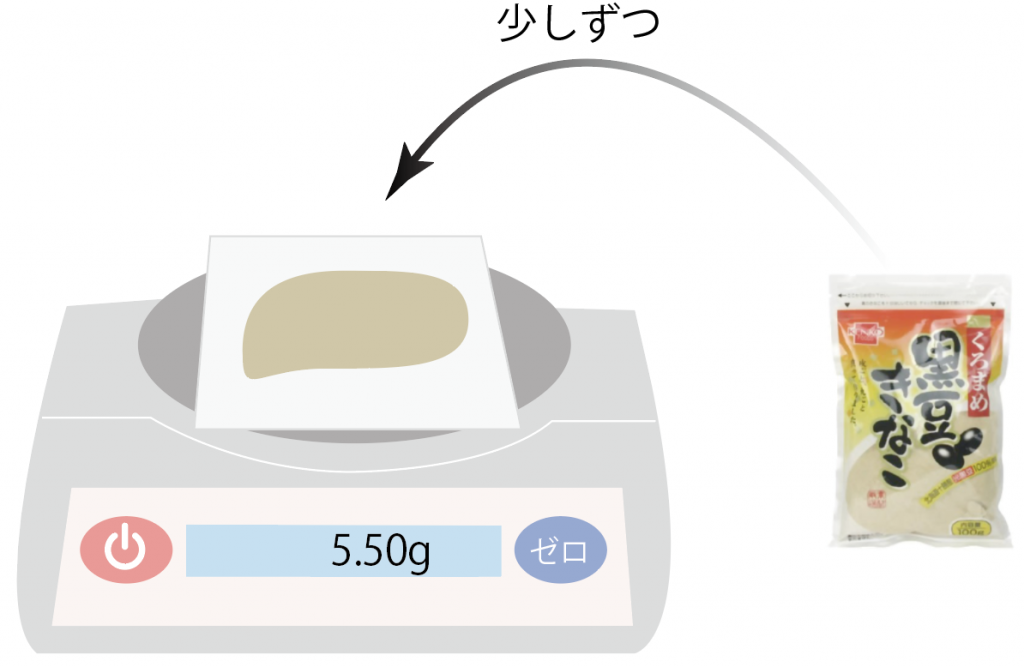
これできな粉5.5gを無事に袋から取り出せたね。
あとは、もちにつけてもいいし、ヨーグルトに入れてもいい。
好きなようにしてくれ。
と、以上が電子天秤の使い方だったね。
使い方の基本は、
水平な場所に電子天秤を置いて、

ゼロリセットで表示を0にして、

ものをのせるだ。

電子てんびんの使い方をマスターした感が出てるけど待ってほしい。
最後に一つだけ、電子てんびんを使う時に注意点が一つだけあるんだ。
それは、電子天秤にははかれる質量の限界があるってこと。
重すぎるものをのせたらぶっ壊れる可能性があるんだ。怖いね。
たとえば、次の電子天秤を例にとってみよう。
こいつは製品のスペック上、
500gのものまでしか測れないことになってるね。
だから、これに1kg(1000g)のきな粉をのせたら壊れちゃう。
ただ、1kgのきな粉は全世界のすべての電子天秤ではかれないかっていうと、そうでもない。
計測できる質量の上限は、
電子天秤の種類によってけっこう違うんだ。
たとえば、こちらの電子天秤なら、5kg(5000g)まで計測可能って書いてある。
さっきの電子天秤で計測できなかった1000gのきな粉の質量もはかれるわけ。
こんな感じで、電子天秤ははかれる重さの上限が決まっているんだ。
電子天秤を使う前に必ず、
「これから使う電子天秤が何gのものまではかれるのか??」
を確認してから丁寧にものを置いて質量を計測してみよう。
そんじゃねー
Ken
こんにちは!この記事を書いてるKenだよ。握りたいね。
中1の理科では、
を勉強したよね??
「公式は覚えられそうだけど、テスト本番で忘れそう・・・」
そんなときは、質量パーセント濃度の問題を解きまくってみよう。
問題を解いて、公式を体に染み込ませる
のが一番なんだ。
今日は公式をマスターするために使える、
質量パーセント濃度を計算する問題
を5つ出題していくよ。
テスト前の腕試ししてみてね。
まずは、
質量パーセント濃度そのもの
を計算する問題だ。
公式に当てはめるだけだから簡単だね。
水と砂糖を混ぜてコップ一杯分の砂糖水200gを作ってみました。
8gのシュガースティックで砂糖を混ぜたとすると、この砂糖水の質量パーセント濃度はいくつになりますか?

この問題は質量パーセント濃度の公式を使うだけ。
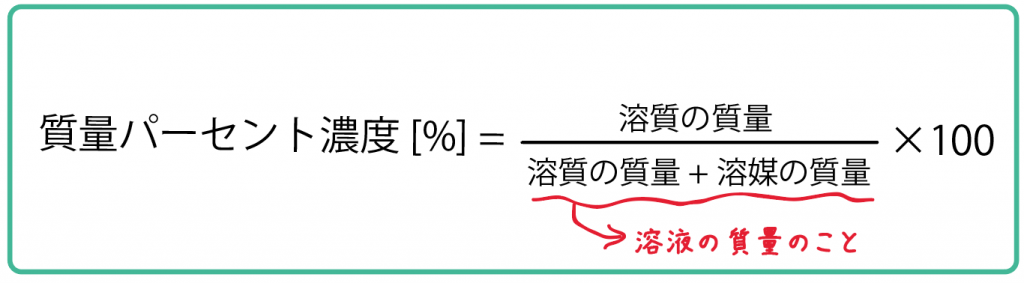
(質量パーセント濃度 [%] )= (溶質の質量)÷(溶液の質量)×100
の公式で計算してみると、

(質量パーセント濃度 [%] )
= (砂糖の質量)÷(砂糖水の質量)×100
= 8 ÷ 200 ×100
= 4 [%]
になるね!
スキムミルク10gと、水200gを混ぜて、牛乳みたいな飲み物を作ってみました。この飲み物の質量パーセント濃度を計算してください。
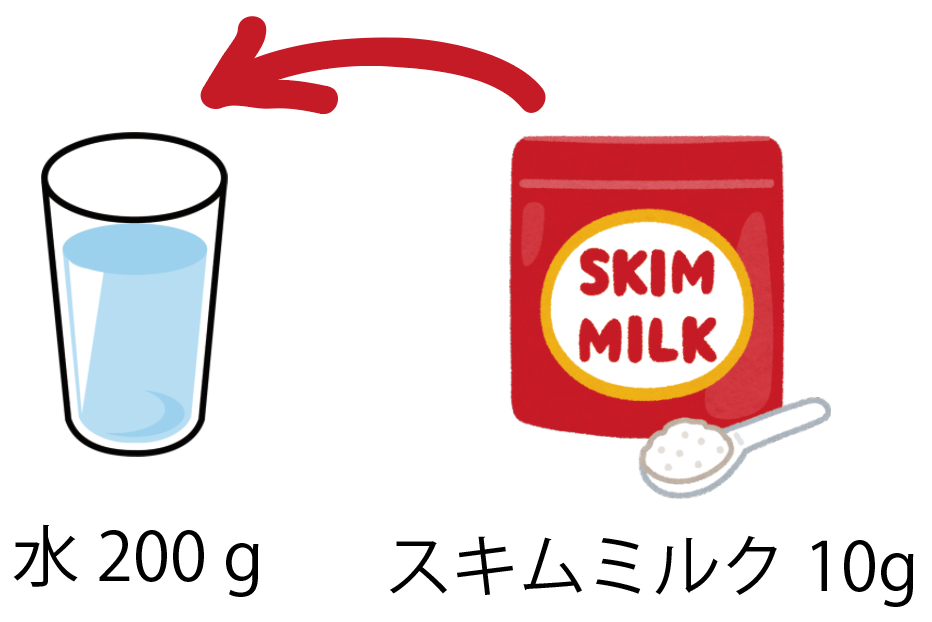
この問題は、
「溶液の質量」が問題に書いてないパターンだね。
こういう問題では、
溶液の質量 = 溶質の質量 + 溶媒の質量
ということを使ってやろう。
つまり、
混ぜてできる溶液は、
200 + 10 = 210g
になるってわけね。
この点に注意して質量パーセント濃度の計算公式を使ってやると、
(質量パーセント濃度 [%] )
= (溶質の質量)÷(溶液の質量)×100
= (溶質の質量)÷(溶質の質量+溶液の質量)×100
= (ミルクの粉の質量)÷(ミルクの粉の質量+水の質量)×100
= 10 ÷(10+200)×100
= 4.76%
になるね!
つぎは、
の質量を計算する問題だ。
ここでは、中1数学で勉強する方程式で解くのが楽だね。
「おいしいココアが飲みたい」と友達に相談すると、
「質量パーセント濃度10%のココアを作るといいよ。お湯とココアの粉使ってね」
と言われました。
質量パーセント濃度10%のココアを、コップ一杯のお湯180gで作りたいとき、何gのココアの粉を使えばいいですか?
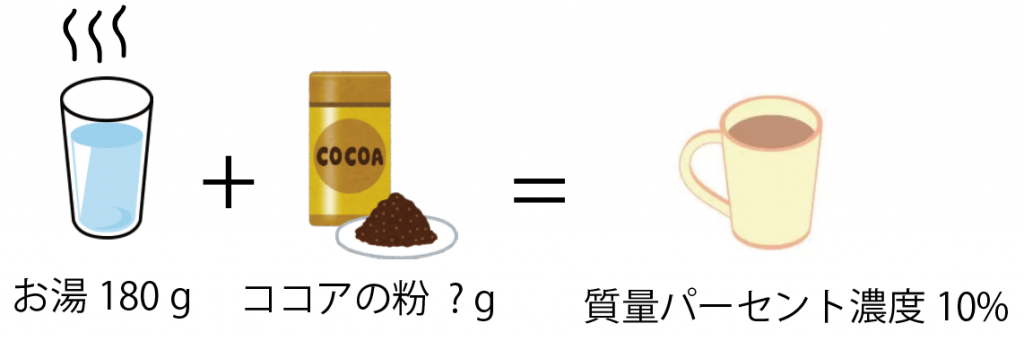
方程式を使って解いてみよう。
溶かすココアの粉の質量を x[g] としよう。
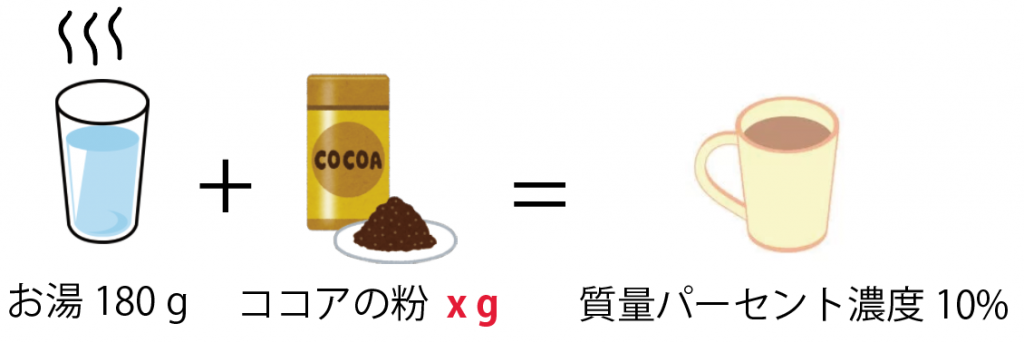
このとき、質量パーセント濃度の公式で方程式をつくると、
(質量パーセント濃度 [%] )= (溶質の質量)÷(溶液の質量)×100
10 = x ÷(x + 180)×100
x = 20 [g]
になるね!
つまり、質量パーセント濃度10%のココアをお湯180gで作るためには、
ココアの粉を20g混ぜればいいってことさ。
質量パーセント濃度20%の濃い抹茶を飲んで、眠気を覚ましたいと思っています。
抹茶の粉末40gを使うとき、お湯を何g混ぜればいいですか?
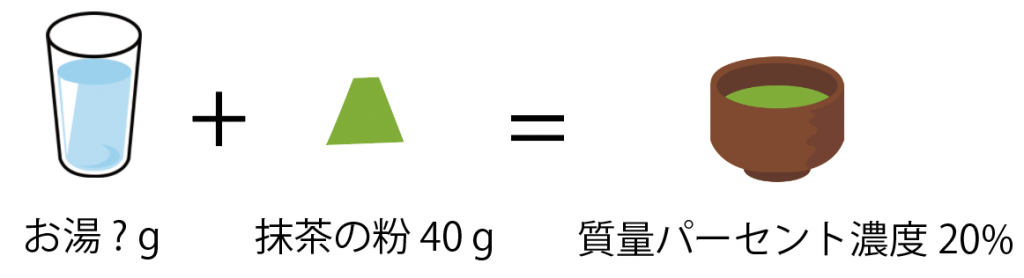
この問題も方程式を使うね。
お湯をx [g]とすると、
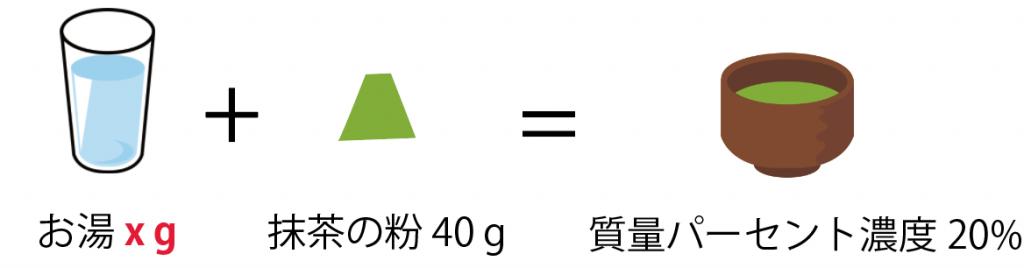
(質量パーセント濃度 [%] )= (溶質の質量)÷(溶液の質量)×100
20 = 40 ÷(40 + x ) × 100
x = 160 [g]
になるね。
「筋肉むきむきになるには、質量パーセント濃度60%のプロテインウォーターを飲むといいらしいよ」そんな噂を耳にして、さっそく作ってみることに。
300gのプロテインウォーターを作りたいとき、プロテインパウダーと水はそれぞれ何gずつ入れればいいですか?

この問題も同じだ。
溶質のプロテインパウダーの質量をx [g] としてみよう。

方程式を立ててみると、
(質量パーセント濃度 [%] )= (溶質の質量)÷(溶液の質量)×100
60 = x ÷ 300 ×100
x = 180 [g]
になるね!
xはプロテインパウダーの質量だったね。
水の質量は、プロテイン溶液の質量300gからプロテインパウダー180gの質量を引けばいいから、
300 – 180
= 120 [g]
になるね!
この5つの問題が解ければ多分大丈夫。
テストでも入試でも抜き打もどんとこいだ。
の2つの解き方をマスターしておこう!
そんじゃねー
Ken
こんにちは!この記事を書いてるKenだよ。タンパク質最高。
中学理科の「身のまわりの物質」という単元では、
密度の求め方
を勉強していくよ。
密度とは、
単位体積あたりの質量のこと
だったね。
もっと簡単にいうと、
ある体積あたり(例えば1cm³)あたり、そいつが何gなのか??
ってことを表した数値なんだ。
密度の出し方は次の公式で計算できちゃうよ。
密度 = 質量 ÷ 体積

つまり、
「重さ」を「大きさ」で割ってあげればいいわけね。
割り算だけだから、簡単に計算できそうなきがするね。
たとえば、ここに1つの野球ボールがあると想像してくれ。

こいつの質量、つまり重さは、120g。
体積は20cm³だとしようか。
こいつの密度を求める時は、さっきの公式を使うと、
120÷20 = 6 [g/cm³]
になるってわけ。

つまり、
野球ボールの1cm³あたりの重さは「6g」ってわけね!
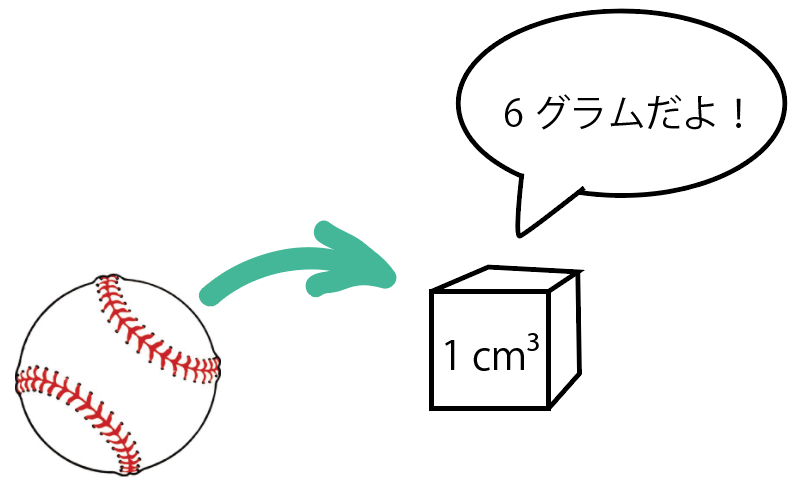
密度の求め方の公式はオッケー!
「重さ」を「体積」で割るだけだもんね。
だけどさ、
密度ってそもそも何の役に立つの?? これ、計算する意味ある??
とか思ってない?。
じつは、密度はこれから将来生きていく中でかなり役立つんだ。
密度を計算すると、
「その物体がどんな物質でできているか」
をだいたい暴くことができるからね。
たとえば、怪しい商人に、
「金の延べ棒1kgを2000万円で買わないか?」
と交渉されたとしよう。

「金の1kgはだいたい3500万円以上する。これはお得な買い物だ!」
そう思うよね??
でも、ちょっと待って。
この延べ棒はもしかしたら金じゃないかもしれないよ?
そういうときは密度を計算してみればいいのさ。
ためしに、重さと大きさ(体積)を測ってみると、
だったんだ。

見た目は金の延べ棒だけだと、本当にそうなのかな??
こういう疑いを持ったときは、密度を調べてみればいいんだ。
密度の出し方の計算公式に当てはめてみると、
密度[g/cm³]
= 質量 ÷体積
= 1000÷111 = 9.001….
だいたい密度が9 [g/cm³]ってことがわかった。

このとき、
「この延べ棒はぜんぶ金でできてないじゃないか!」
ってだまされずに気づくことができるんだ。

なぜなら、
金の密度は19.32[g/cm³]になるはずだからね。
物質によって密度が違うから、すぐに金じゃないって気づくことができるね。
あぶねえあぶねえ。
ちなみに、密度がだいたい9[g/cm³]の物質は、
銅。
十円玉と同じ素材だね。
もし、金という名前で銅を売られそうになったら、
どう見ても銅だろ!
と一喝してやろう。

密度の求め方はもう完璧だね。
密度[g/cm³] = 質量[g] ÷体積[cm³]
ようは、
「重さ」を「大きさ」で割ってあげればいいんだ。
密度を計算すると、
「その物質が何でできているのか??」
がわかるから、日常生活でもだまされにくくなるから心強いね。
金を売られそうになったら、密度を計算してみよう。
そんじゃねー
Ken