
中学理科の勉強する化学変化の中には
- 発熱反応
- 吸熱反応
という2種類があるよ。
どちらも「熱」に関係してそうな反応っぽいけど、一体こいつらはどう違うのか??
ここでは、この2つの発熱反応と吸熱反応の違いを勉強していこう。
発熱反応と吸熱反応の違いとは??
違いはズバリ、
熱を奪うのか化学変化なのか、
それとも、
熱を発生させるのか化学変化なのか、
だね。
つまり、熱のありなしで違うんだ。
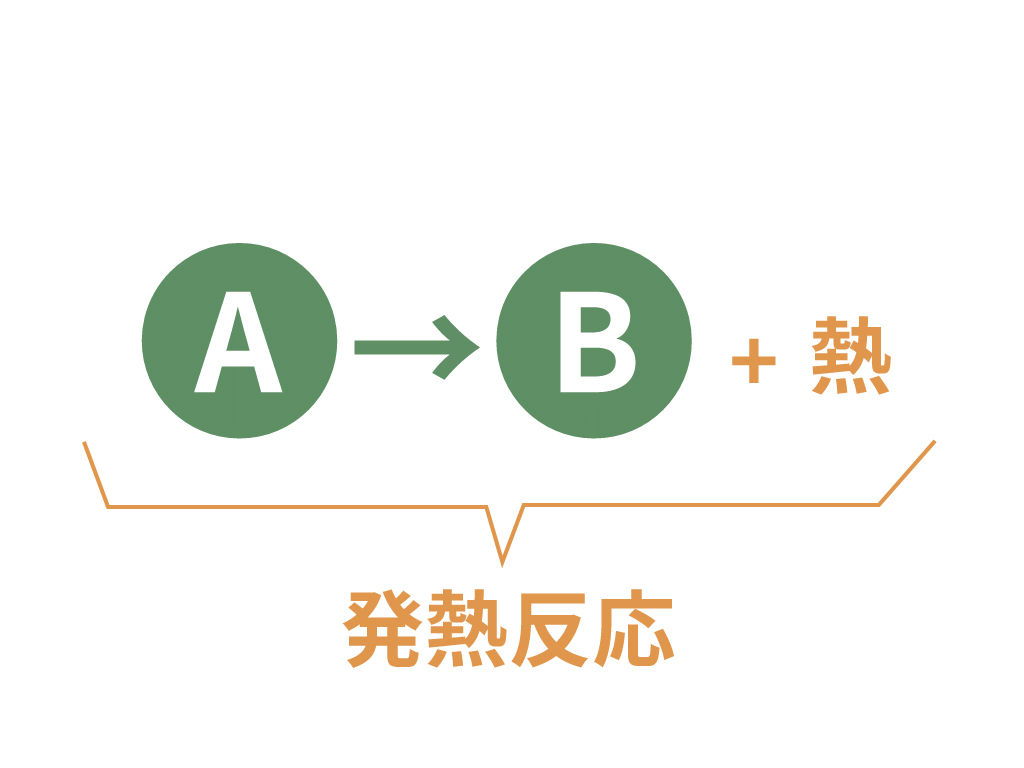
発熱反応
発熱反応は文字通り、
熱の発生というイベントが発生する化学変化のこと
さ。
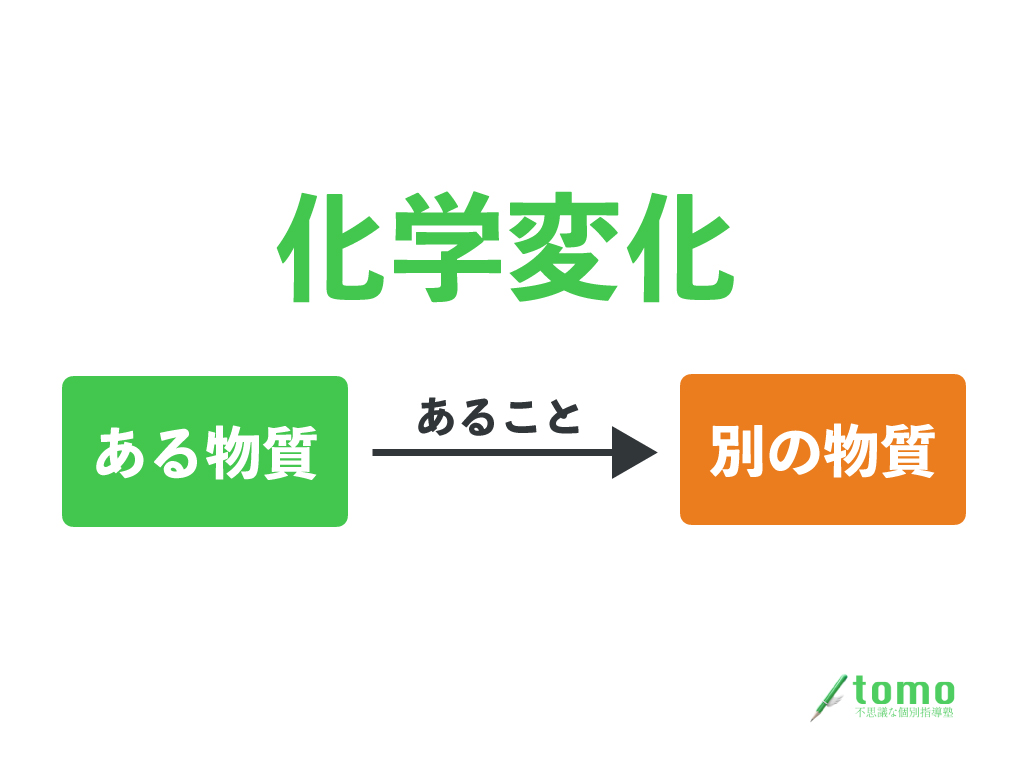
化学変化とは、
ある物質が別の物質になる変化のこと
だったよね。
ある物質が別の物質になったとき、それと同時に、
周囲に熱を発生させる反応のこと、
これを発熱反応というんだね。
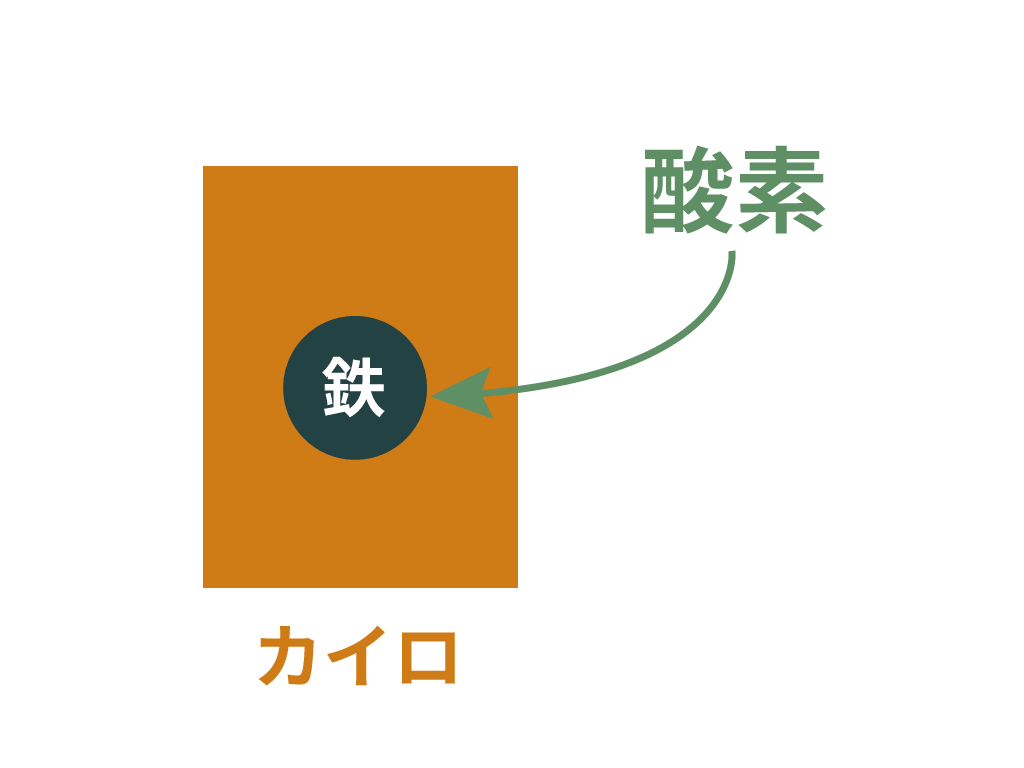
例えば、発熱反応の具体例にはカイロがあるよ。
カイロの中身は鉄粉。

そう、鉄の粉なんだ。
この小さい小さい鉄の塊が、空気中の酸素に触れて酸化する。
すると、鉄は酸化鉄に進化。
この
$$\ce{鉄 + 酸素 -> 酸化鉄}$$
という反応は発熱反応であることと確かめられているんだ。
周囲に熱をはなちながら反応するのね。
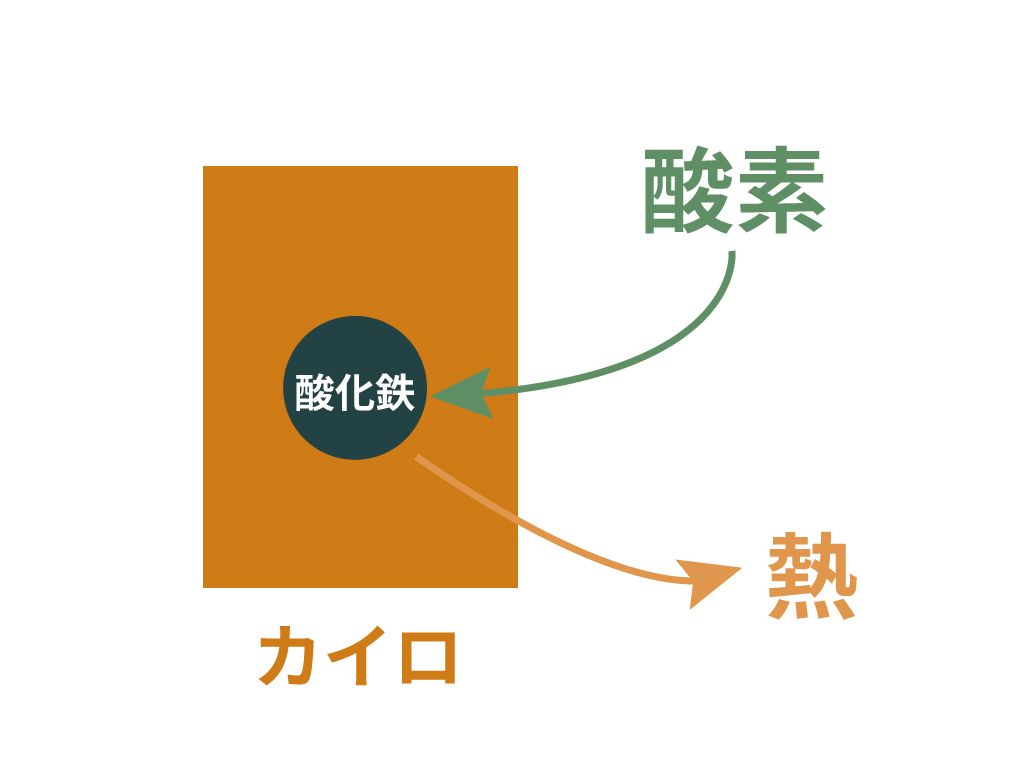
だから、カイロ全体を空気に触れさせてやれば、鉄が酸化されて、酸化鉄になる反応が起きて、ついでに熱も発生させてくれるわけさ。
吸熱反応
吸熱反応も文字通り、
周囲から熱を吸い取る、というイベントが発生する化学変化のことさ。
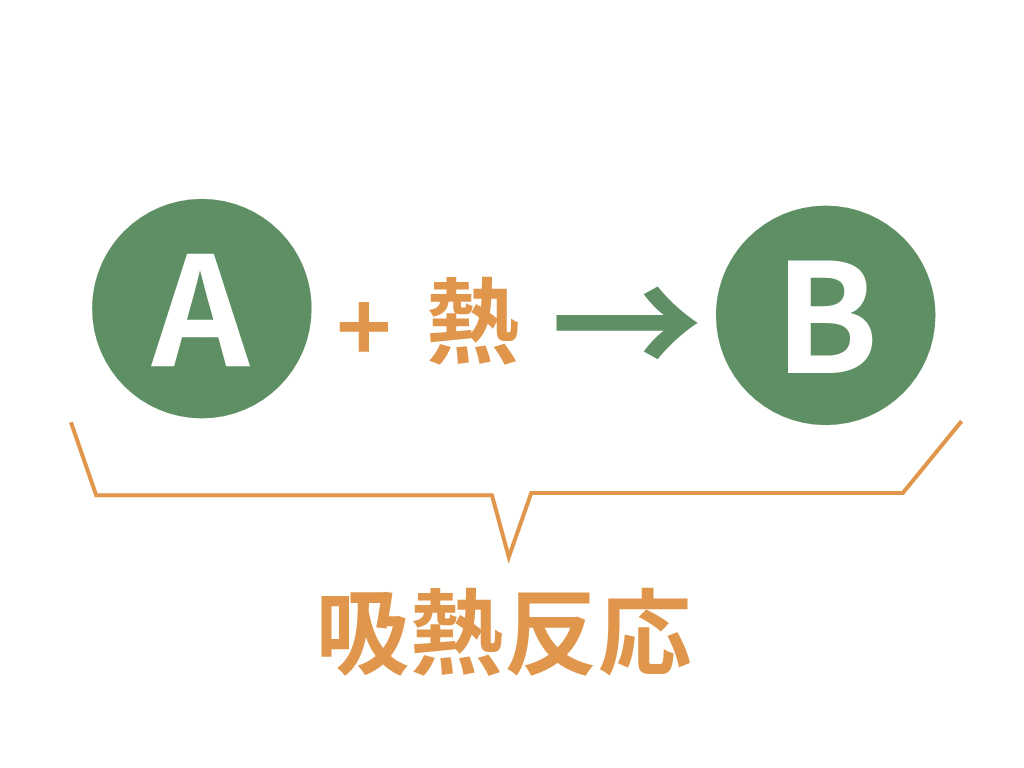
熱の出入りで見ると、さっきの発熱反応とは逆だね。
例えば、冷却パック。
このパックの中身はおもに
- 硝酸アンモニウム
- 水
が入っている。そして、この2つは別々に分かれているのね。

で、冷やしたくなったお客さんが外から衝撃を加えて水の袋を割る。
そうすると、水と硝酸アンモニウムが混じり合うんだ。

すると、水に硝酸アンモニウムが溶け始めて化学変化が発生。この水と硝酸アンモニウムが一緒になる化学変化は吸熱反応であると実験で確かめらてているんだ。
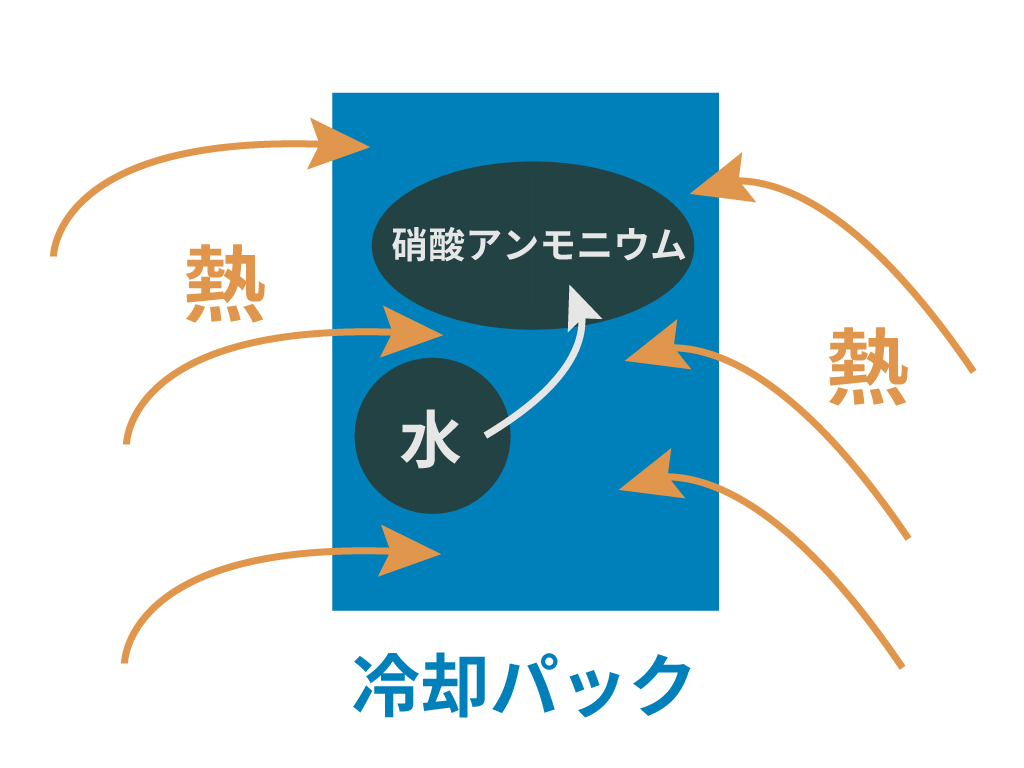
だから、結果的に冷却パックに衝撃を加えてやればパック周辺が冷えるってわけさ。
なぜ発熱反応と吸熱反応で熱が出入りするのか?
ここで気になってくるのが、
なぜ化学変化の前後で熱が発生したり熱を奪ったりする現象が起きるのか?
だよね。
じつはこれ、
化学変化の前後で化学エネルギーの差があるからなんだ。
そのエネルギーの差が熱となって出たり、また周囲から熱を奪ったりするのさ。
化学エネルギーとは、
ある物質が持っているエネルギーのこと
だよ。
例えば物質 A にはかけ物質 A の化学エネルギーがあるし、物質 B には物質 Bの化学エネルギーがある。
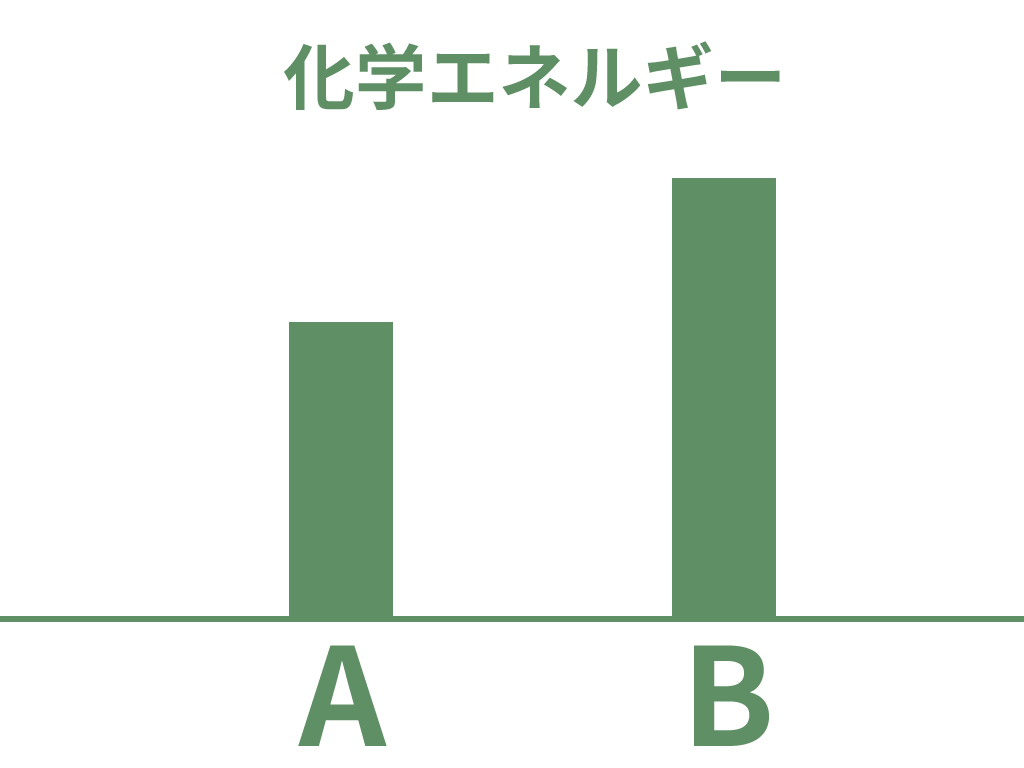
そして、その化学エネルギーの大きさは物質によって異なるんだ。
化学変化の前後でできる物質の化学エネルギーが小さくなったらどうなる?
その時は、そのエネルギー差を埋めるために熱を発生させて埋め合わせるんだ。
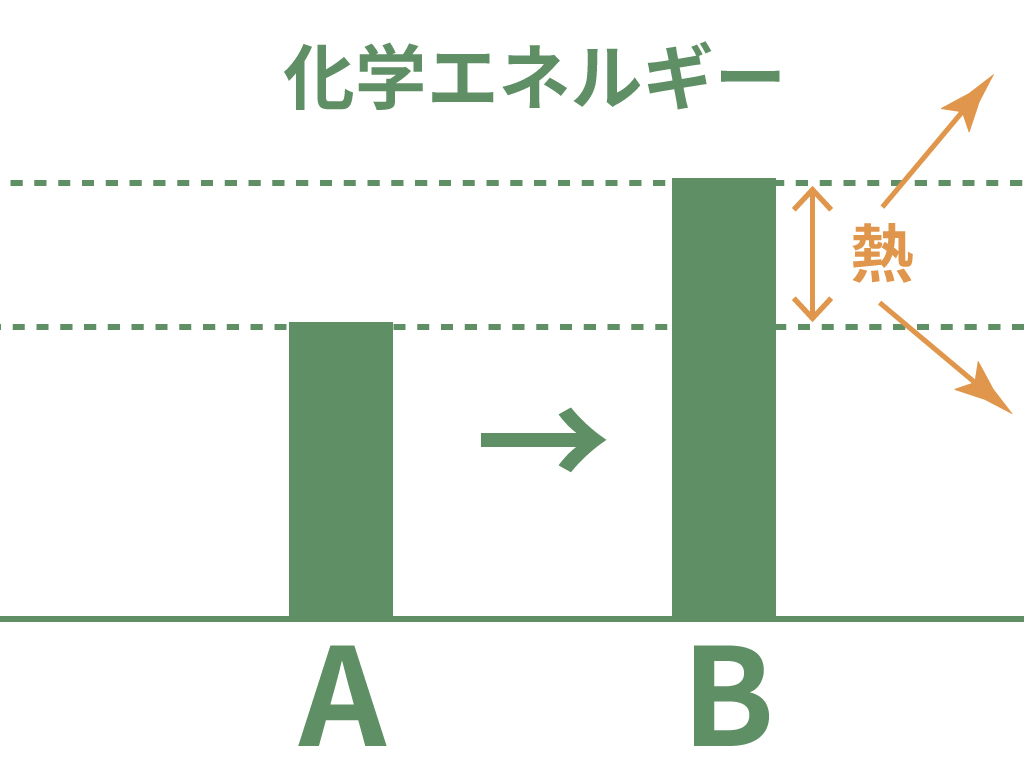
逆に、化学変化して新しい物質になったら化学エネルギーが大きくなったらどうなる?
その時は、周囲から熱を奪うことで化学エネルギーが大きい物質になってその差を埋め合わせるんだ。
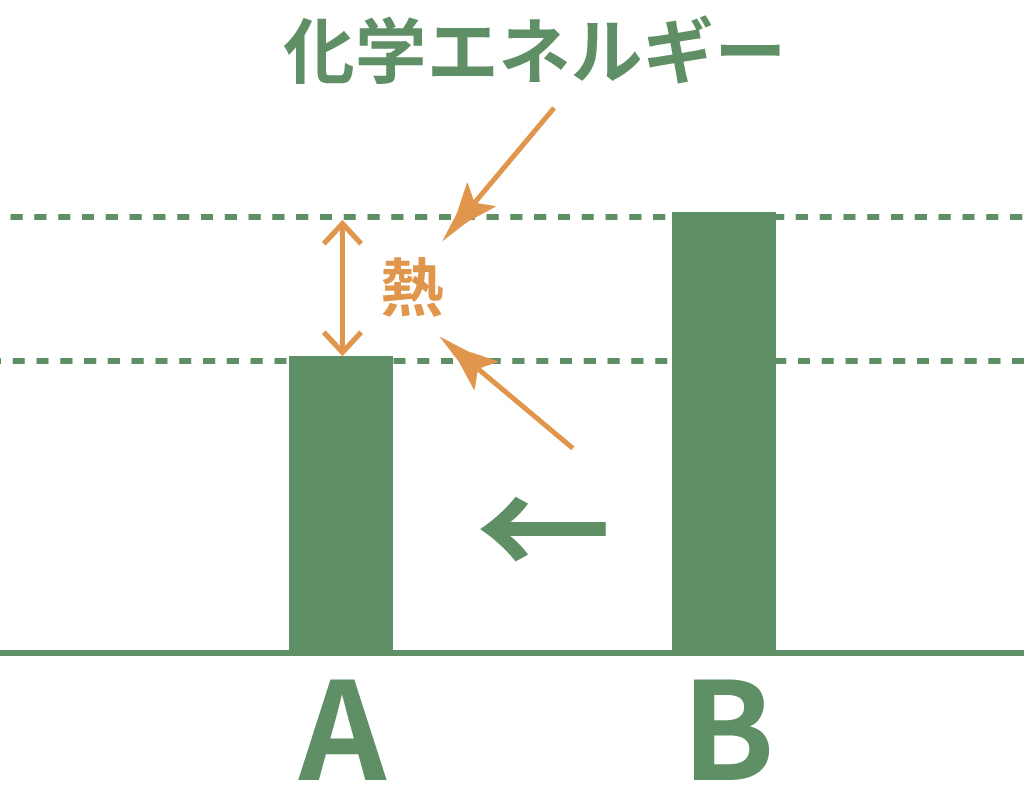
つまりは、
化学変化の前後で化学エネルギーを同じに保とうとする
わけさ。この現象が「発熱反応」と「吸熱反応」になってあらわれているのね。
うん、以上!
ここまでの勉強で中学2年生の理科の化学変化の単元はおしまい。

そんじゃねー









