【中学理科】化学反応式の作り方・問題の解き方がわかる3ステップ
化学反応式の作り方・問題の解き方がわからん!?
こんにちは、竹生まれの妖精ドイサキだよ!クイックル最強だね

中学理科でよく質問をうけるのが、
化学反応式の作り方・問題の解き方
だ。
化学式とか元素記号とかぶっちゃけむずいけど、
中2理科では、ガンガン問題にでてくるよ。
そこで今日は、中2理科を制するために、
化学反応式の作り方を4ステップで解説してみた。
よかったら参考にしてみてね。
化学反応式の作り方がわかる4ステップ
化学反応式の作り方のポイントは1つしかない。
それは、
変化前後の原子の数をあわせること
だ。
えっ。どうやって原子の数をあわせるのかって??
じつは、変化前後の化学式の係数をいじって原子数を調整するんだ。
やってることは汚いかもしれない。
だけど、ものすごくシンプルなのさ。
つぎの4ステップでつくれちゃう。
- とりあえず変化をかいてみる
- 左右の原子の数を数える
- 化学物の係数をあわせる
- 単体の係数をあわせる
例として、
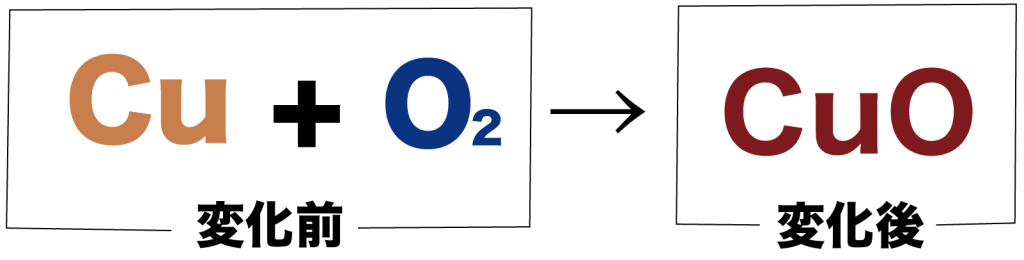
銅(Cu)が酸素(O2)と結合して酸化銅(CuO)になる事象
を化学反応式にしてみようか。
Step1. いったん化学反応式をかく
とりあえず化学反応式を書いてみよう。
変化前後で原子の数があってなくても大丈夫。
のちのち調整していくからね。
化学反応式では2つの物質を「+」でつないで、
「→」のあとに化学変化後の物質をおけばいいよ。
「→の左側」が「変化前」、
「→の右側」が「変化後」をあらわしているんだ。
例の化学反応では、
- 銅(Cu)
- 酸素(O2)
がくっついて、
CuO
になるんだよね??
だから、今回では、変化前の、
- Cu
- O2
を+でむすぶ。
そいつらが酸化銅(CuO)になるから、酸化銅は→の右側におく。
すると、
Cu + O2 → CuO
こうなるね!
原子の数はいったんスルーでOKさ。
Step2. 左右の原子の数をかぞえる
つぎは、変化前後の原子の数をかぞえよう。
- →の左側にある原子の数
- →の右側にある原子の数
を確認すればいいんだ。
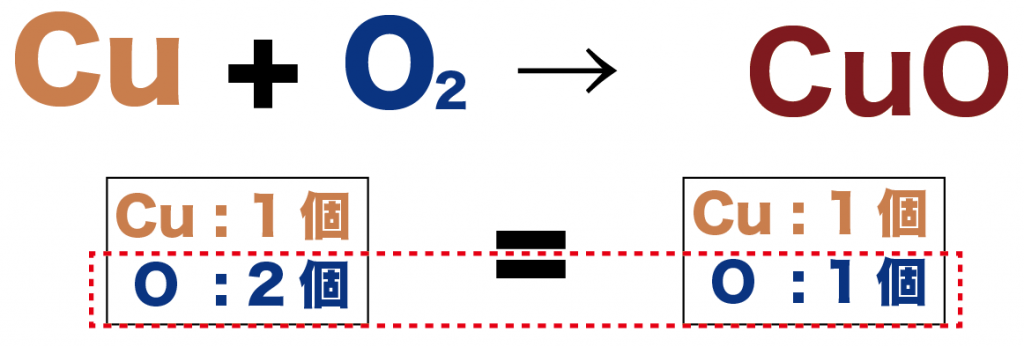
例題だと、変化前には、
- Cu: 1個
- O:2個
で、変化後に、
- Cu: 1個
- O: 1個
になってるね!
どうやらこの化学反応式では、
変化前後で酸素原子(O)の数がおなじじゃない・・・!
なんとかせねば。。
Step3. 化合物の係数をいじる
変化前後の原子の数がちがうときは、
化学式の係数をいじる
ことで原子数をあわせていくよ。
まずは化合物(いくつかの原子がくっついてるやつ)の係数をいじるんだ。
例の酸素と銅の化学変化では、
酸化銅(CuO)
が化合物だ。
酸素と銅が組み合わさってできているからね。
変化後の酸素原子数を変化前の原子数にあわせるために、
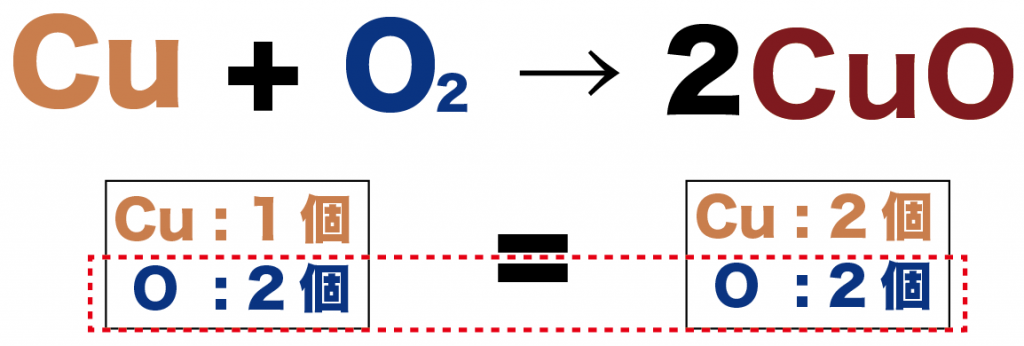
この酸化銅(CuO)の係数を2にしてみようか。
すると、
Cu + O2 → 2CuO
になるね。
で、変化前後の原子の数をチェックしてみると、
変化前
- 銅(Cu) : 1
- 酸素(O): 2
変化後
- 銅(Cu) : 2
- 酸素(O): 2
っていう感じで、酸素原子数がおなじになったね!いいぞ!
Step4. 単体の係数をいじる
今度は、化合物じゃない物質たちの係数をいじってみよう。
ほとんどの場合、単体の係数をいじることになる。
酸化銅の化学反応式では、
変化前のほうがCuが1つ少ないよね??
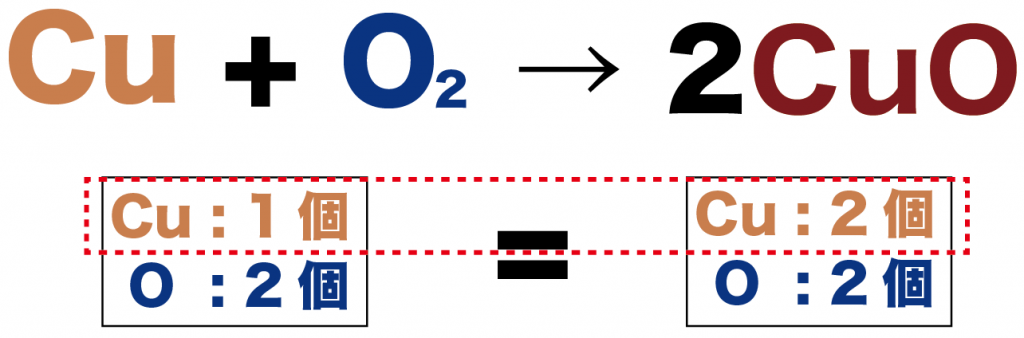
だから、変化前のCuの係数を2にしてやると、
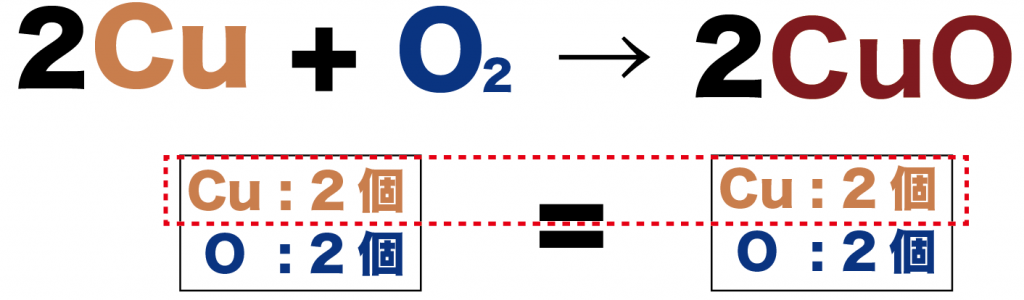
2Cu + O2 → 2CuO
こうなる。
変化前後の原子数をくらべてみても、
- 銅(Cu ): 2個
- 酸素(O): 2個
ってかんじで、等しくなったことがわかるね。
これで化学反応式の完成だ!
まとめ:化学反応式の作り方は係数をいじれ!
化学反応式はめんどうそう。
だけどね、
係数をいじるワザ
をおぼえちまえば簡単。
変化前後の原子の数をあわせるだけだからね。
じゃんじゃん係数をかえていこう!

次は「化合の意味」に迫っていくよ。
そんじゃねー