【中3理科】イオンとは何かわかりやすく解説してみた

おっと、最初に言っておくけどな・・・・
イオンはイオンでも、近所にある大型スーパーのことじゃねぇぞ。
「イオンとは何か」って言われたら、あのイオンが頭をよぎっちまうよな。その気持ちはわかる。
でも今回の「イオン」は、
理科で出てくる “電気を帯びた原子” のこと
なんだ!
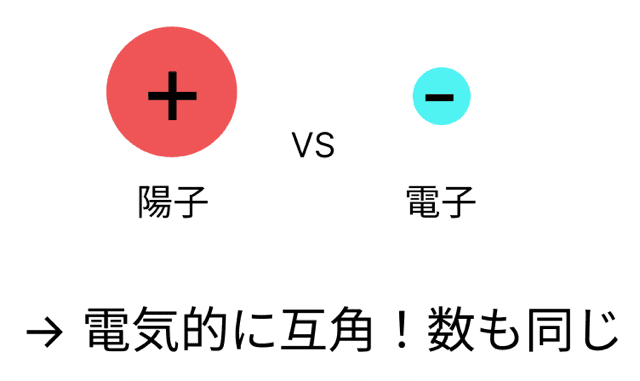
前回、原子っていうのはプラスとマイナスの電気がちょうど打ち消しあって「電気を帯びていない」って話をしたよな?
でもな…
あるきっかけで、この電気的なバランスが崩れることがあるんだ。
その結果、
電気を帯びた特別な状態 = イオン
になるってわけよ。
というわけで、今回はその「イオン」について、ばっちり解説していくぞ。
イオンとはなにもの?
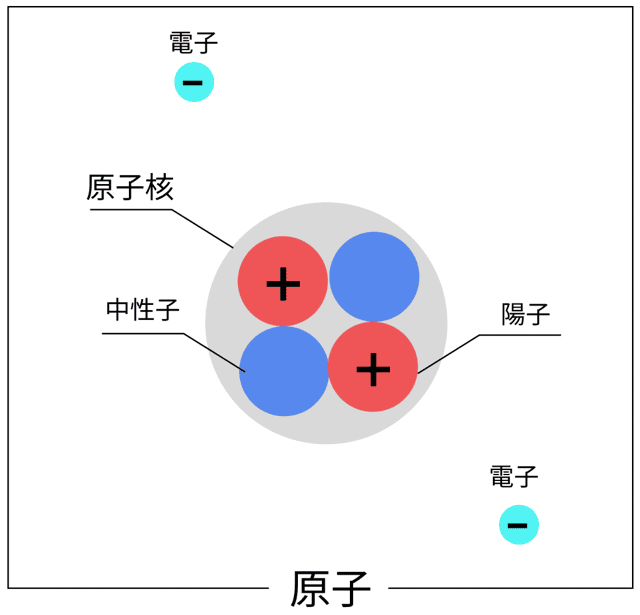
ふつう、原子っていうのは、プラスの電気を持った陽子と、マイナスの電気を持った電子が同じ数だけあって、電気的に中性になってるんだったな。
でもな、
電子を失ったり、逆に多くもらっちゃったりすると、原子の電気のバランスが崩れちまう!
その結果、電気を帯びた原子になる。
この状態の原子を「イオン」って呼ぶんだ!
陽イオンとは?
まずは「陽イオン」から。
これは、
電子を失って、プラスの電気を帯びた原子
のこと!
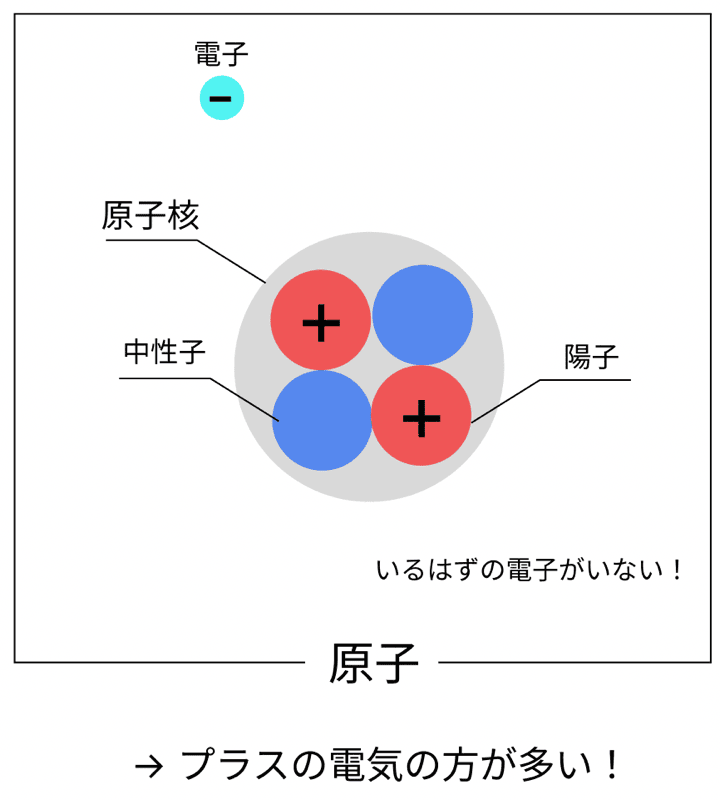
たとえば、ナトリウム原子(Na)が電子を1個失うと…
→ Na+(陽イオン)になるんだ!
陰イオンとは?
続いて「陰イオン」。
これは、
電子を受け取って、マイナスの電気を帯びた原子
のこと!
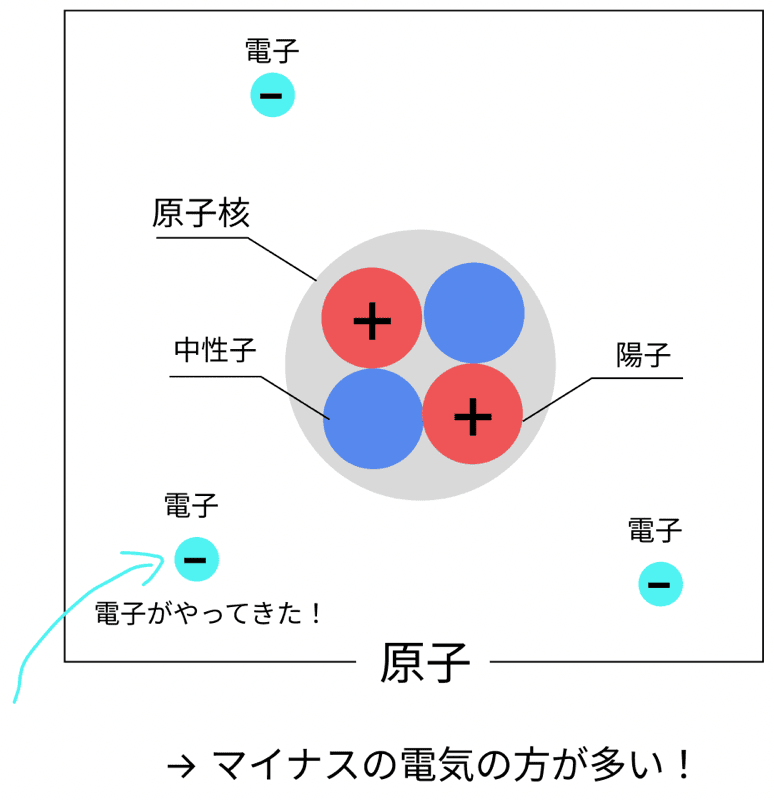
たとえば、塩素原子(Cl)が電子を1個受け取ると…
→ Cl−(陰イオン)になるぞ!
イオンって、クラスの男女比が変わるようなもん!?
ここで、ちょっとイメージしやすい例え話をしよう!
あるクラスに男子10人・女子10人いたとする。
このとき、クラスはちょうどよく男女比のバランスが取れてる状態だよな?
これが「電気を帯びていない原子(中性)」の状態!
でもさ、突然、男子の転校生が1人やってきたらどうなるよ?
そう、
男子11人、女子10人。
ちょっと男子が多くなって男女比のバランスが崩れたよな?
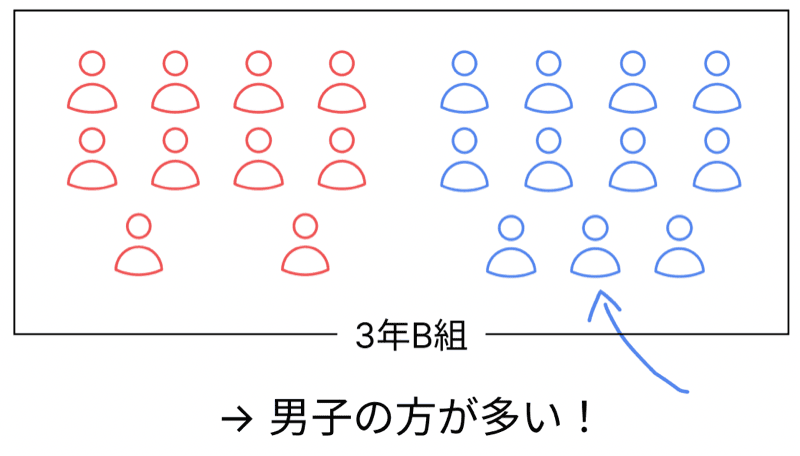
これが、「プラスの電気が多くなった=陽イオン」のイメージ!
逆に、男子が1人、引っ越して別の学校に行ったら?
そう、
男子9人、女子10人。
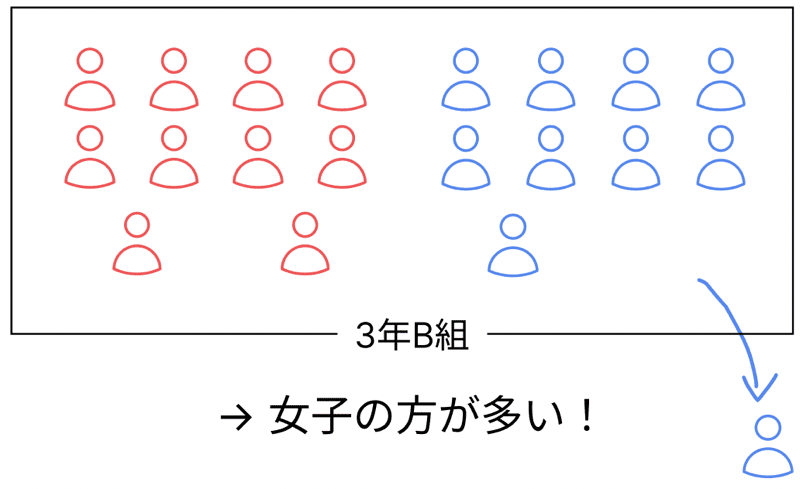
今度は女子の方が多くなって、「マイナスの電気が多い=陰イオン」になる感じ!

次は、イオンを記号で表すイオン式の書き方を見てみようぜ!



