
イオン化傾向?それは何かって?オラにまかせろ!
イオン化傾向とは、
金属のイオンになりやすさ
だ!
イオン化傾向が大きい金属ほど、より簡単にイオンになるんだ。
たとえば、ナトリウム(Na)は、塩酸に入れるとすぐに溶けて水素を発生する。
だけど、銅(Cu)はそう簡単には溶けないんだ。
つまり、ナトリウム(Na)と銅(Cu)はイオンになりやすさが違うってことったな。
この金属がイオンになりやすいかどうかを表す順番が、イオン化傾向なんだ。
イオン化傾向の順番はズバリ、
Na > Mg > Al > Zn > Fe > Cu > Ag
だ!
語呂合わせで覚えるのがポイントだぞ!
オリジナルの語呂合わせ、こんなのどうだ?
納豆マグのアルバム全部フェリーで食ってあげる
この語呂合わせは、こんな感じでイオン化傾向の順番に対応してるな。
納(Na)豆マグ(Mg)のアルバム(Al)全部(Zn)フェ(Fe)リーで食(Cu)ってあげる(Ag)。
シチュエーションとしては、納豆専門のマグカップについて歌ったバンドのアルバムを全部フェリーの上で食ってあげる、って宣言があったシーンをイメージしてくれ。

これでみんなもイオン化傾向が頭にしっかり入るはずだ!
ピンときたか?
イオン化傾向とは、
金属のイオンになりやすさ
で、順番は
Na > Mg > Al > Zn > Fe > Cu > Ag
だ。これを覚えてテストを突破しようぜ!


マンガン電池は身近にあるけど、どうやって電気を作るか知らないヤツもいるかもな。
ガンマン電池・・・と間違えるなよ!

おいらと一緒に、マンガン電池の仕組みを見ていこう!
マンガン電池っていうのは、中の材料が力を合わせて電気を作り出してるんだ。
中をのぞいてみよう。
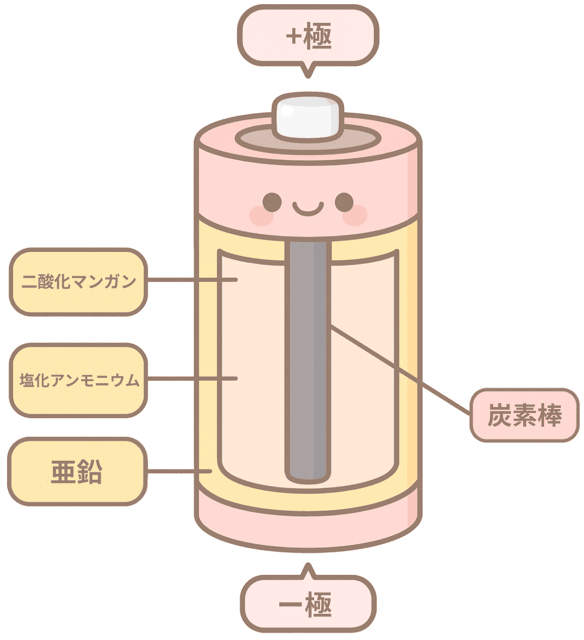
マンガン乾電池の内部には、一極で亜鉛、+極で二酸化マンガンが働いているんだ。
電解質の水溶液は、塩化アンモニウムを含む塩化亜鉛水溶液だ。
この電池の力は、どんな風に流れてるのかな?
電池の中では化学反応が起きているって話だぜ!
一極の亜鉛が酸化され、電子を失って電解質に溶ける。
その電子が電流として炭素棒を通って、+極に移動するんだ。
そこで、+極の二酸化マンガンが電子を受け取って還元され、新しい物質に変わる。
これがマンガン電池の仕組みだ!
マンガン電池の仕組み、ポイントをしっかり押さえよう!


燃料電池とは、水の電気分解と逆の化学変化を利用する電池だ。
つまり、
水素と酸素が化学変化を起こすときに発生する電気エネルギーを取り出す装置
なんだ。
これってめちゃくちゃエコだよな!
びっくりするけど、この電池から出るのは
水だけ。
地球にやさしいんだ!

燃料電池って、学校の化学の授業で習った水の電気分解とは逆のことをやってるんだ。
念のために電気分解を復習しておこう。
電気分解とは、
電気エネルギーを使って化学物質を分解する反応のこと
だったよな?
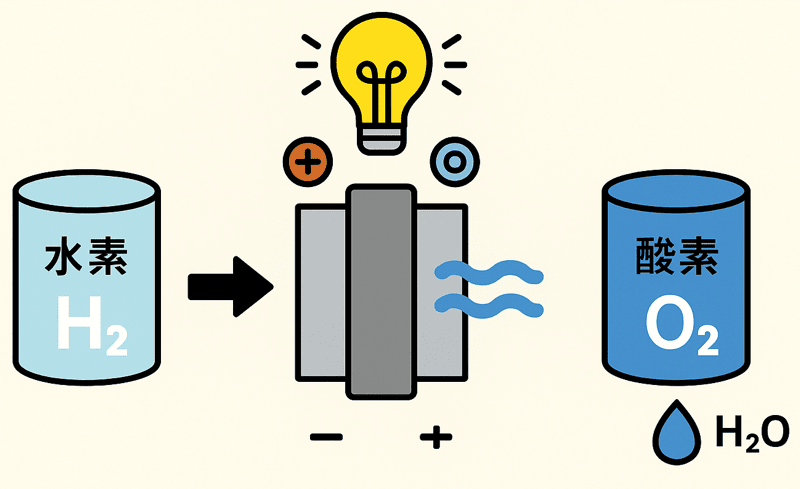
電気分解では、水($ \ce{H2O} $)を電気で分解して、水素($ \ce{H2} $)と酸素($ \ce{O2} $)にする。
逆に燃料電池では、水素と酸素が合わさって水を作るときに電気を生み出すんだよ。
さて、ここで化学大好きなキミのために化学反応式を紹介するぞ。
水素と酸素がくっついて水を作る反応式は、ズバリ、
$$ \ce{2H2 + O2 -> 2H2O + 電気エネルギー} $$
だ。
ツボは、水素と酸素が合体することで電気が生まれるってところさ!
燃料電池にはいくつかの種類があるんだけど、今回はその中でもリン酸型燃料電池に注目してみよう。
このタイプは、中学校や高校の教科書に登場することが多い形で、高温環境でも使われるんだ。
何よりも、燃料電池は長い時間電流を取り出せるし、有害な物質を発生しないという特徴があるぞ。


ズバリいっちまうぞ。
一次電池と二次電池の違いはな、
充電できるかどうか
だ!

一次電池は、使い切りの電池だ。
つまり、
充電できない電池
ってことったな。
使うと電圧が低下し、もう元に戻らない。
充電はできないから、使ったら捨てるしかないんだ。
たとえば、次の電池たちが一次電池だ。
二次電池は、充電してくり返し使える電池だ。
つまり、
充電できる電池
さ。
外部から逆向きの電流を流すと、電圧が回復して再利用できる。
これを充電っていうんだ。
たとえば、次のような電池が二次電池さ。
一次電池と二次電池の違いのポイントを次の表にまとめておくぞ。
| 特徴 | 一次電池 | 二次電池 |
|---|---|---|
| 充電 | できない | できる(くり返し使える) |
| 寿命 | 使い切り | 長く使える |
| 身近な例 | 乾電池、リチウム電池、空気電池 | 車のバッテリー、スマホ、ノートPC |
オッケー、一次電池と二次電池の違いはわかったな。
でも、学校のテストではわかっただけじゃ許されねえ。
どの電池が、一次なのか二次なのか見分けねえといけねえな。
そこで、おいらがお前らのために一次電池と二次電池の覚え方を生み出してやったぞ。
一次電池の覚え方はズバリ、
あくまのいうこともに一理あり
だ。

あ(アルカリ乾電池)・く(空気電池)まのいうことにも一(一次電池)理(り)(リチウム電池)あり
二次電池の覚え方はズバリ、
チリチリにいちゃんと虹
だ。

チ(鉛蓄電池)・リ(リチウムイオン電池)チリに(ニッケル水素電池)いちゃんと虹(二次電池)


おっす、それじゃあ早速解説していくぞ!
ダニエル電池は、イギリスの科学者ダニエルさんが1836年に発明した電池だ。
亜鉛板(Zn)と銅板(Cu)を使い、それぞれを硫酸亜鉛水溶液(ZnSO₄)と硫酸銅水溶液(CuSO₄)に入れて作るぞ。
そして、硫酸亜鉛水溶液と硫酸銅水溶液の間をセロハンや素焼き板で仕切るんだ。
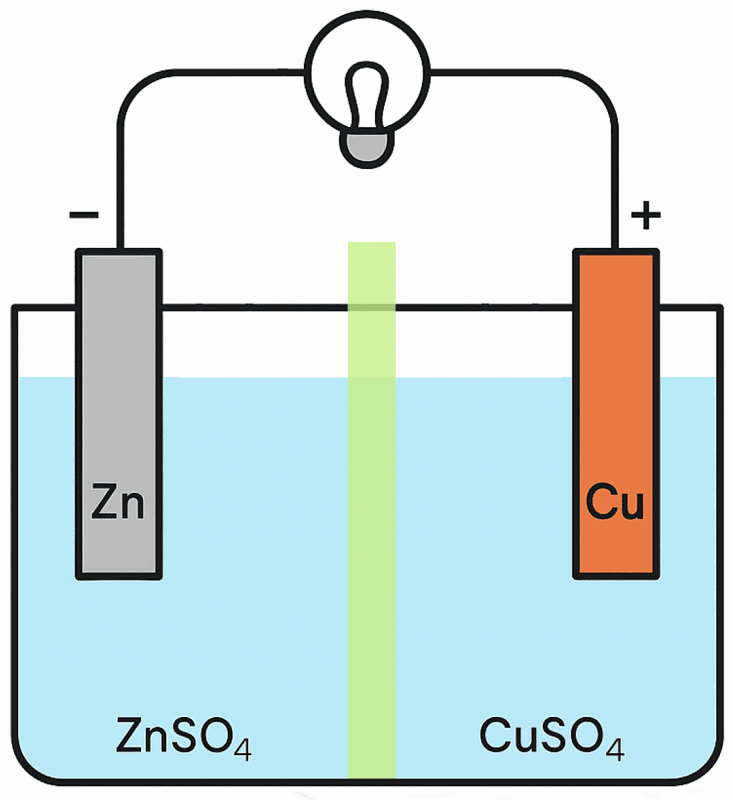
すると、次のような仕組みで亜鉛板と銅板に電流が生じるぞ。
ダニエル電池では、硫酸亜鉛水溶液と硫酸銅水溶液の間をセロハンや素焼き板で仕切ったよな?
じゃあ、その役割は何だろう??
じつはセロハンは、
「仕切りの壁」だけど「イオンは通す」フィルター
なんだ。
セロハンで式っておけば、2種類の溶液が直接混ざらない。
でも、イオンは少しずつ移動できる!
このセロハンさんがないとな、溶液が混ざって、正しく反応が進まず電池にならないんだぜ!

これでダニエル電池もバッチリ理解できたはずだぜ!

レモンの果汁にはクエン酸がたっぷり含まれている。

この酸が「電解質」としてはたらき、電気を流す準備をしてくれるんだ。
レモンに銅板と亜鉛板を差し込んで導線でつなげば、レモン電池の出来上がり!
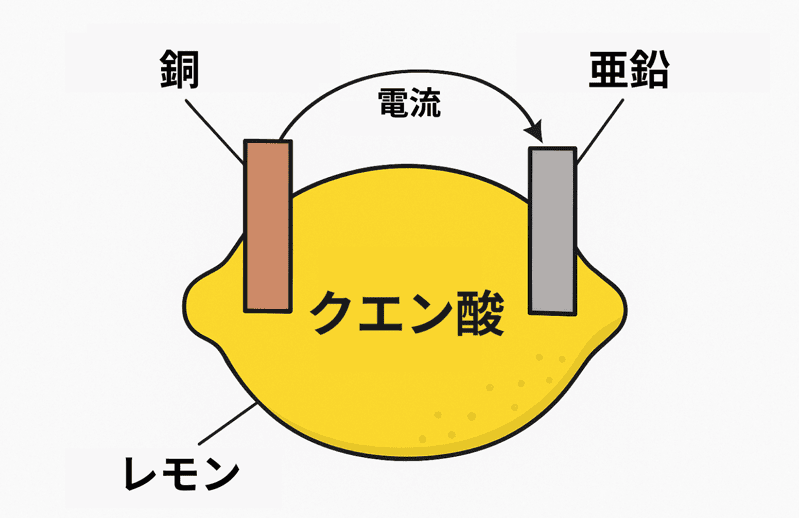
えっ。なぜレモンが電池になるのかって??
それは次のような仕組みだ。
この電子の流れこそが電流さ。
つまり、レモンの酸と2種類の金属がそろえば、電気を取り出せるってことさ!
果物電池はどの果物でも基本の仕組みは同じさ。
「酸を含む果汁」+「異なる2種類の金属板」で電気が生まれるんだ。
ただし、果物ごとに酸の種類や濃さが違うから、電圧や持続時間に差が出るんだな。
ズバリ、酸っぱい果物ほど電池に向いているぞ。
逆に、酸が少ない果物は電流が弱すぎて電池としてはイマイチなんだ。
| 果物 | 電池にできる? | ポイント |
|---|---|---|
| レモン | ◎ | クエン酸が多く、電圧が安定 |
| グレープフルーツ | ◎ | 果汁が多く、レモンと同じ仕組みで使いやすい |
| キウイ | ◎ | 酸味が強く、電流も比較的安定 |
| オレンジ・みかん | ○ | 酸が少なめなので電圧は弱い |
| トマト | ○ | グルタミン酸や有機酸で電池になる |
| りんご | ○ | リンゴ酸がはたらくが酸は弱め |
| バナナ | △ | 酸が少なく、ほとんど電流が流れない |
| メロン | △ | 甘みが強いが酸が少ないため不向き |
それはね……酸は水に溶けるとイオンに分かれるからさ。
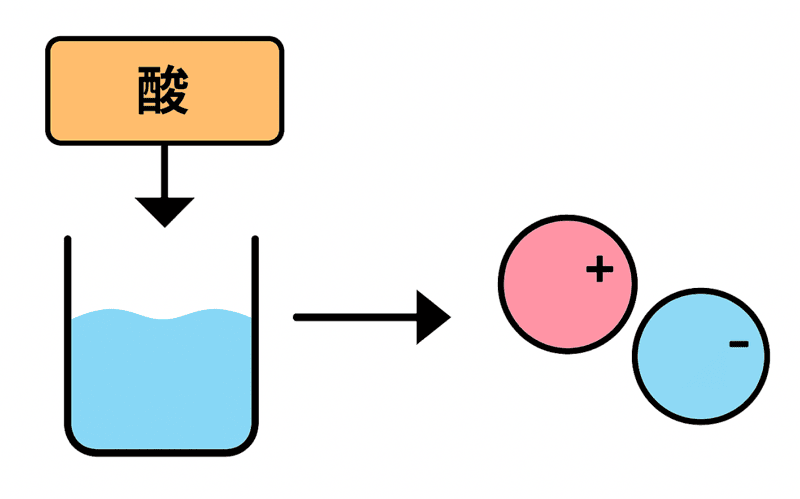
電解質っていうのは、
水に溶けてイオンになり、電流を流すことができる物質のこと
だったな。
酸の正体をもう少し見てみよう。
水に溶けると次のように分かれる。
HCl → H+ + Cl−
水素イオン(H+)と塩化物イオン(Cl−)に分かれるから、電気を運ぶことができるんだ。
レモンやグレープフルーツに含まれるクエン酸も同じ。
水に溶けるとH+(水素イオン)を出して、残りが陰イオンになる。
クエン酸 → H⁺ + (残りの陰イオン)

あれ・・・銅って何もしてない・・・・?
いいところに気がついたな!
実はそこに重要な理由があるんだ。
結論からいうと……
銅はほとんど何もしないから選ばれているんだ。
「えっ、何もしないなら意味ないじゃん!」って思うかもしれないけど、逆なんだな。
銅が選ばれる理由は次の通り。
もし銅の代わりに、電子を出しやすい金属を使ったら……
その金属まで反応しちゃって、電池として成り立たなくなるんだ。
だからこそ、「何もしない=安定している」銅が選ばれているんだよ。
たとえ話ならこんな感じだ ↓



ズバリいっちまうぞ。
中学理科の実験で登場する木炭電池とは、
木炭、アルミはく、食塩水を利用して電気を発生させる電池のこと
だ。
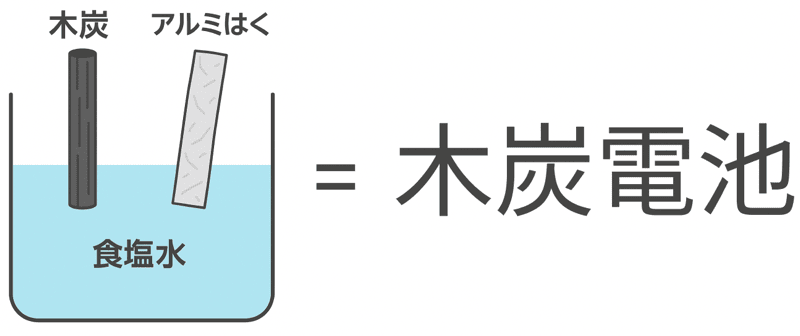
木炭電池では、食塩水(=電解質)にアルミはくと木炭を入れることで、電子のやり取りが起こるぞ。
つまり、
アルミが溶ける → 電子が流れる → 水素が発生する
という流れで電気エネルギーが取り出せるんだ。
木炭電池に長時間電流を取り出すと、アルミはくがぼろぼろになってしまう。
これはアルミがどんどんイオンに変化して溶け出すからだ。
つまり、アルミは自分の体を削って電気を生み出しているってこと!

これが木炭電池のポイントさ。
このことから、木炭電池は、
アルミの化学エネルギーを電気エネルギーに変換している
ともいえるな!
これは身の回りの乾電池や充電池と同じ仕組みだ。
電池は、いろんな物質の「化学変化する力」をうまく使って、電気を作り出す装置といえるな。
「木炭電池って、アルミがぼろぼろになるだけでデメリットしかないんじゃ?」
と思うかもしれないな!
でも、実はこんなメリットがあるぞ。
つまり木炭電池は、「シンプルで安全に、電池の仕組みを学べる教育用電池」として最高ってわけよ。
実験向きで、理科の授業や自由研究でよく使われるのも納得だな!


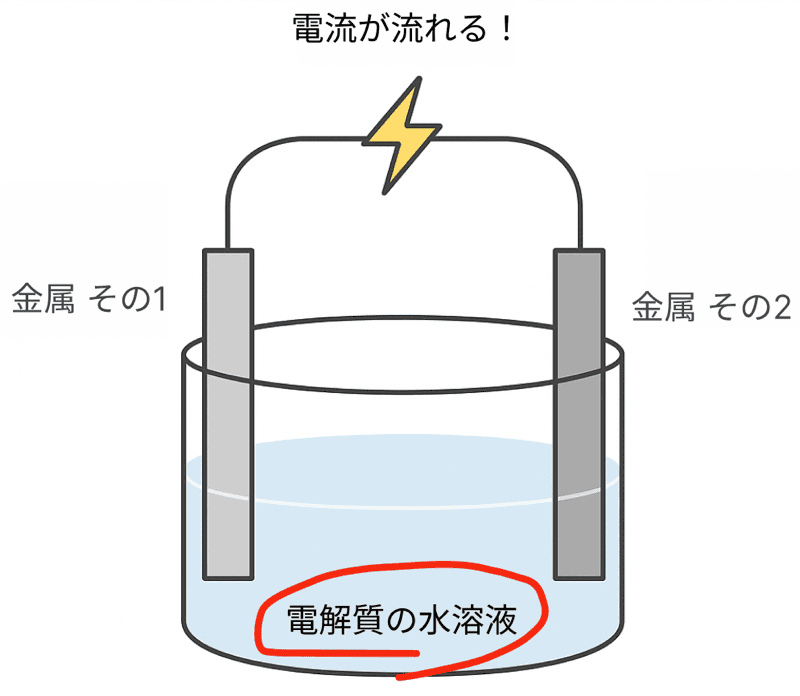
中学理科の実験で、
電解質の水溶液(うすい塩酸など)に2種類の金属板を入れ、導線でつなぐ
なんてことしなかったかい。
その結果、金属と金属の間に電圧が生まれて、電流を取り出せたよな!
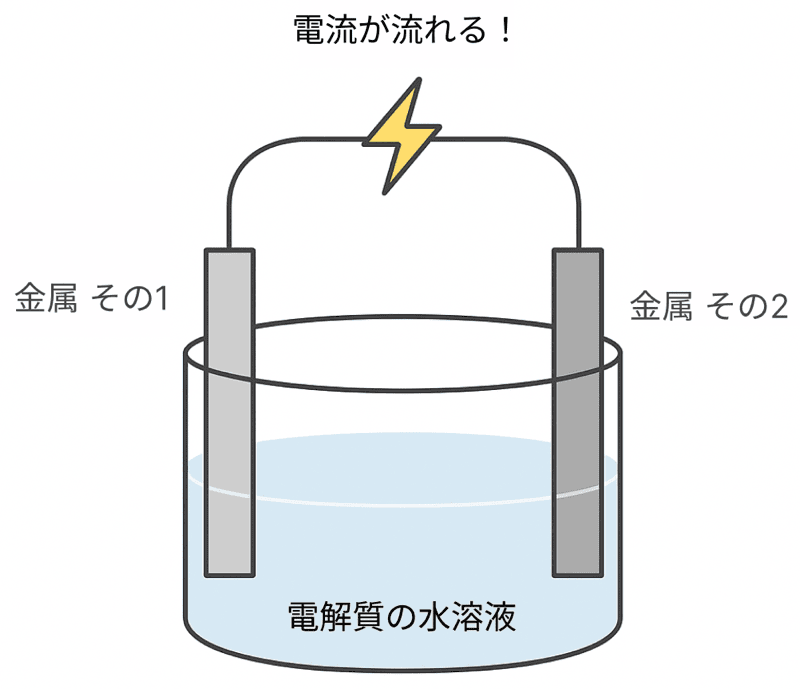
このように化学変化を利用して電流を取り出す仕組みを持つものを「電池」というぞ!
同じ種類の金属板を2枚入れても、電圧は発生しない。
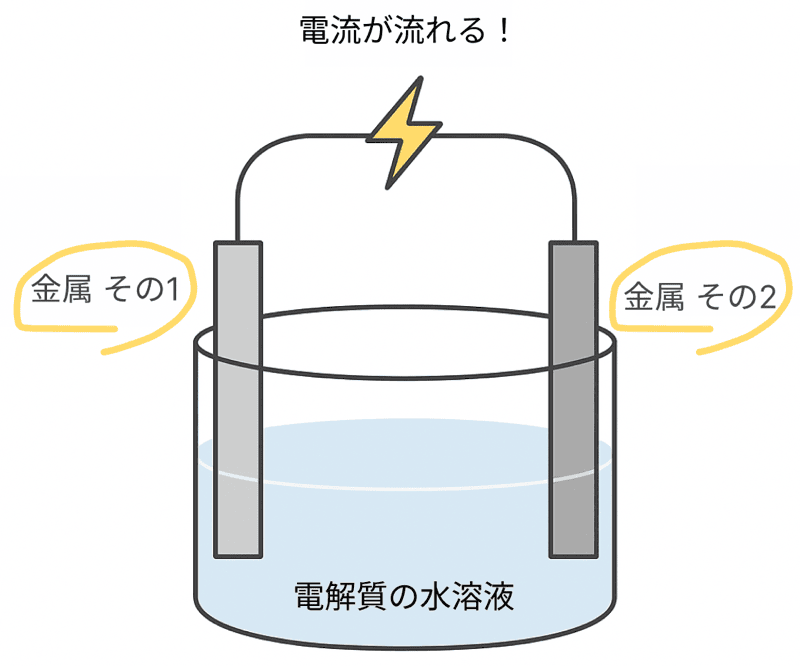
つまり電池としては機能しないんだ。
電圧の大きさや、どちらがプラス極・マイナス極になるかは、組み合わせる金属板の種類によって決まるぞ。
電解質(水に溶けるとイオンになる物質)の水溶液に金属板を入れると電流を取り出せるけど、
砂糖水のような非電解質の水溶液では電流は流れない!
ってことも覚えておこうな。
以上のことをまとめると、次のようになるぞ。
イオンが存在する水溶液+異なる金属板 → 電流を取り出せる
イオンがない水溶液+異なる金属板 → 電流を取り出せない


理科の実験で、いろんな水溶液に電流計をつないでみたことがあるよな?
この結果からわかるのは…
水に溶かす物質によって、電気を通すか通さないか変わる!
ってことだ。
で、
水に溶かしたときに電気を通す物質
を「電解質」。
水に溶かしても電気を通さない物質
は「非電解質」ってわけよ。
つまり、電解質と非電解質の違いは、
水に溶かしたら電気を通すのかどうか
ってことなんだな。
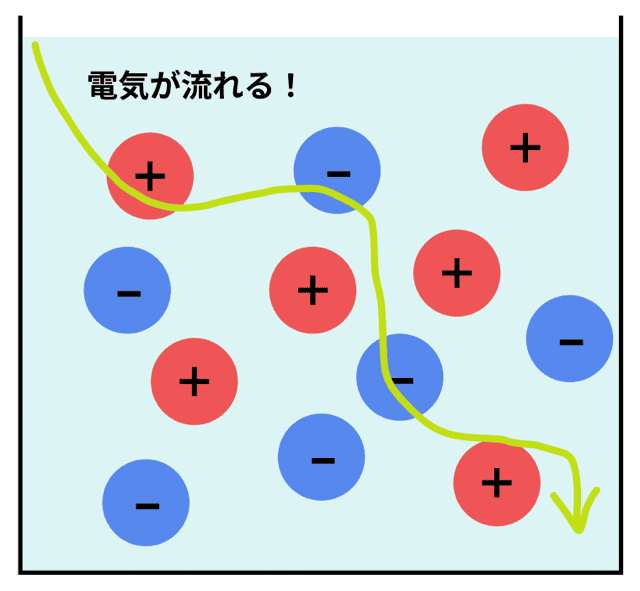
電解質の代表例は、塩化ナトリウム(食塩)や塩化水素など。
水に溶けると電離して、陽イオンと陰イオンに分かれるんだ。
このイオンが電流を運ぶから、電気が流れるってわけさ。
砂糖やエタノールのように、水に溶けても電離しない物質のこと。
電離しない=水溶液中にイオンが存在しないから、電気は流れないぞ。
オッケー、今日はここまで!
本日の学び、まとめておくぞ。
| 水溶液の種類 | 電流の流れ | 溶質の分類 | 電離の強さ |
|---|---|---|---|
| 食塩水 | よく流れる | 電解質(NaCl) | 強電解質 |
| うすい塩酸 | よく流れる | 電解質(HCl) | 強電解質 |
| 雨水 | わずかに流れる | 電解質(CO₂など溶解) | 弱電解質 |
| スポーツドリンク | わずかに流れる | 電解質(Na⁺, K⁺など) | 弱電解質 |
| 水道水 | わずかに流れる | 電解質(Ca²⁺, Mg²⁺など) | 弱電解質 |
| 砂糖水 | 流れない | 非電解質(C₁₂H₂₂O₁₁) | ― |
| エタノール水溶液 | 流れない | 非電解質(C₂H₅OH) | ― |


電離(でんり)って聞くと、なんだか難しそうな名前だよな?
でも実は、電離っていうのは、化学の世界では結構シンプルな出来事なんだ!
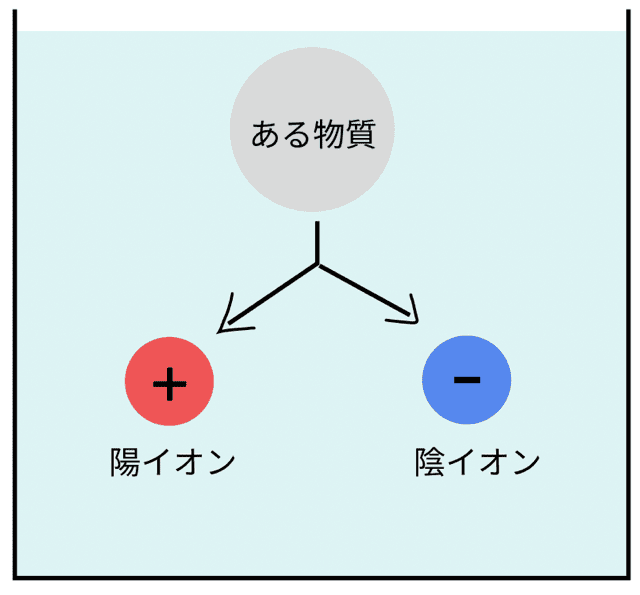
まずは結論から。
物質が水に溶けて、陽イオンと陰イオンにバラバラに分かれること
これが電離だ!
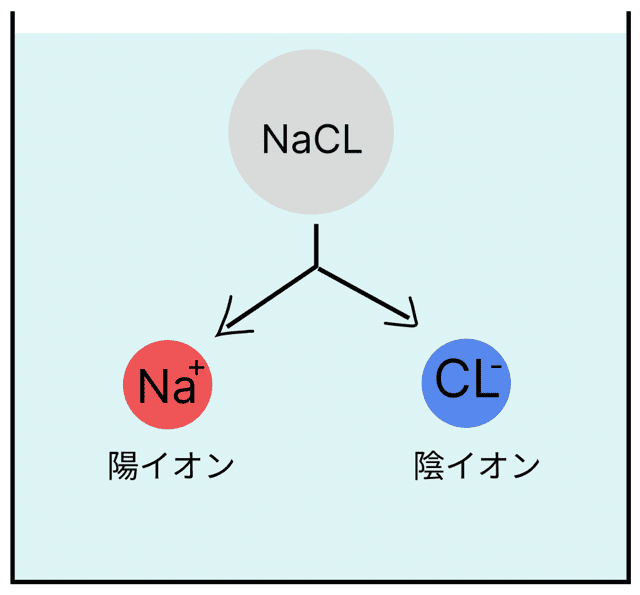
例えば、食塩(塩化ナトリウム)は水に溶けると…
この2つに分かれるんだ。
電離は、イオン式でこんなふうに書けるぞ。
NaCl → Na+ + Cl−
HCl → H+ + Cl−

電離って聞くと難しそうだよな。
でも、「水に溶けてイオンになる」ってだけの話なんだぜ!
次は、電解質と非電解質の違いも見ていこうな!

「イオン式」って、どうやって書けばいいんだ…!?
「記号の右上に+とか−とか書けっていうけど、実際どれがどれかわかりにくい…!」
そんなキミのために、今回は中学理科で習う「イオン式の書き方」をわかりやすくまとめていくぞ!
イオン式とは、イオンになった原子や原子の集まりを記号で表したもののことだ!
たとえば、ナトリウム(Na)が電子を1個失ったとする。
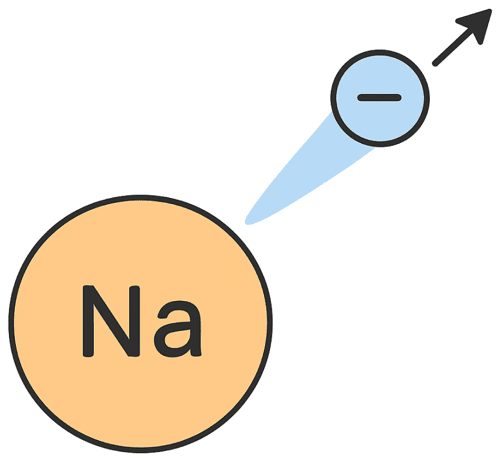
そのときのイオン式はこれだ ↓
Na+
イオン式は次のルールで書いていくぞ。
例:
Na → Na+
Ca → Ca2+
例:
Cl → Cl−
O → O2−
右上の数に注目してくれ!
この数字たちはズバリ、
普通の原子がイオンになる時にやりとりした電子の数さ!
2個電子を失ったら2を書くし、3つゲットしたら3を書くんだ。
| 元素名 | イオン式 | 意味 |
|---|---|---|
| ナトリウム | Na+ | 電子を1個失った |
| カルシウム | Ca2+ | 電子を2個失った |
| 塩素 | Cl− | 電子を1個受け取った |
| 酸素 | O2− | 電子を2個受け取った |
でも、1の場合は数字の1を書かない点に注意しような。これは数学のお作法と一緒って覚えておこう。
ここまで出てきたイオンは、1つの原子が電子をやりとりしてできたもの(単原子イオン)だったよな。
でも、イオンの世界にはもう1つ重要な仲間がいる。それが多原子イオンだ!
多原子イオンとは、
2個以上の原子が結びついて1つのグループになり、全体として電気を帯びているイオンのこと。
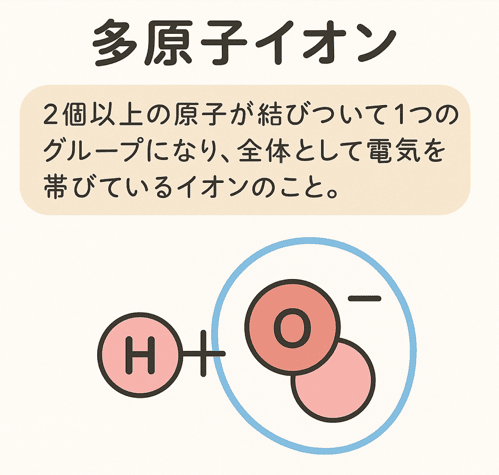
この「原子の集まり」全体が+や−の電気を持っているんだ。
たとえば、水酸化物イオン(OH−)は酸素(O)と水素(H)がセットになってマイナスの電気を帯びている。
硫酸イオン(SO₄2−)は硫黄(S)と酸素(O)がくっついてマイナス2個分の電気を帯びているんだ。
多原子イオンのポイントは以下の通りさ。
テストでは「OH− や SO₄2− は単独の原子じゃない」ってことを理解しておくのが大事だぞ!


おっと、最初に言っておくけどな・・・・
イオンはイオンでも、近所にある大型スーパーのことじゃねぇぞ。
「イオンとは何か」って言われたら、あのイオンが頭をよぎっちまうよな。その気持ちはわかる。
でも今回の「イオン」は、
理科で出てくる “電気を帯びた原子” のこと
なんだ!
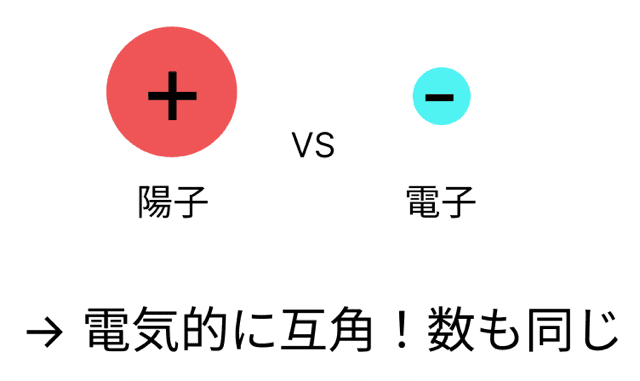
前回、原子っていうのはプラスとマイナスの電気がちょうど打ち消しあって「電気を帯びていない」って話をしたよな?
でもな…
あるきっかけで、この電気的なバランスが崩れることがあるんだ。
その結果、
電気を帯びた特別な状態 = イオン
になるってわけよ。
というわけで、今回はその「イオン」について、ばっちり解説していくぞ。
ふつう、原子っていうのは、プラスの電気を持った陽子と、マイナスの電気を持った電子が同じ数だけあって、電気的に中性になってるんだったな。
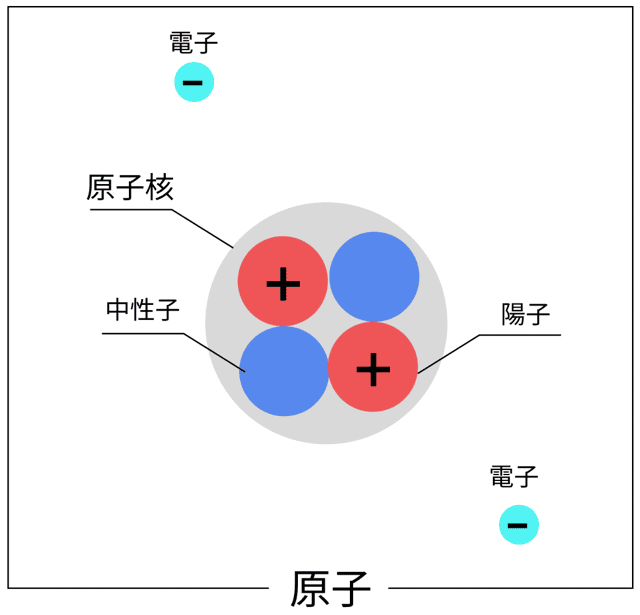
でもな、
電子を失ったり、逆に多くもらっちゃったりすると、原子の電気のバランスが崩れちまう!
その結果、電気を帯びた原子になる。
この状態の原子を「イオン」って呼ぶんだ!
まずは「陽イオン」から。
これは、
電子を失って、プラスの電気を帯びた原子
のこと!
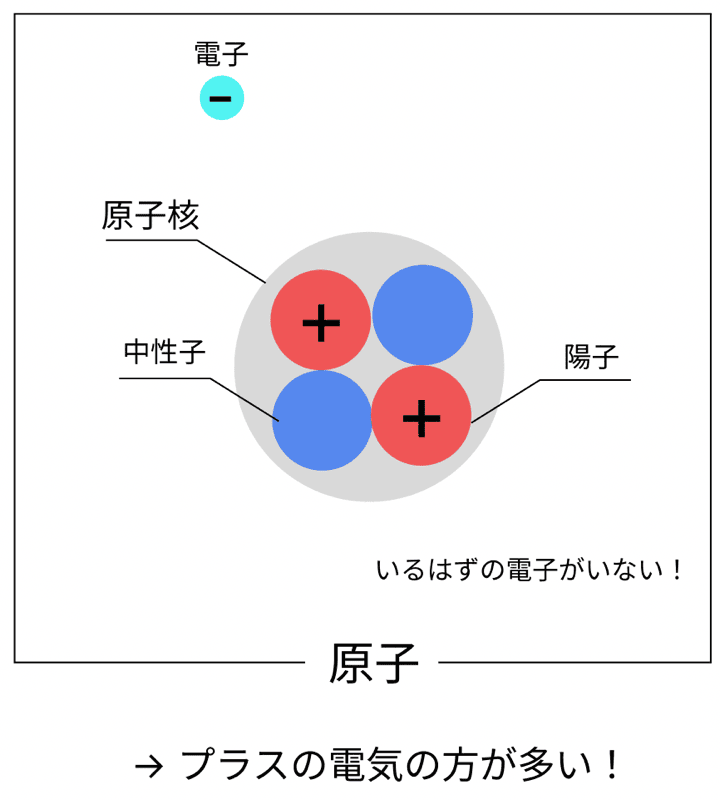
たとえば、ナトリウム原子(Na)が電子を1個失うと…
→ Na+(陽イオン)になるんだ!
続いて「陰イオン」。
これは、
電子を受け取って、マイナスの電気を帯びた原子
のこと!
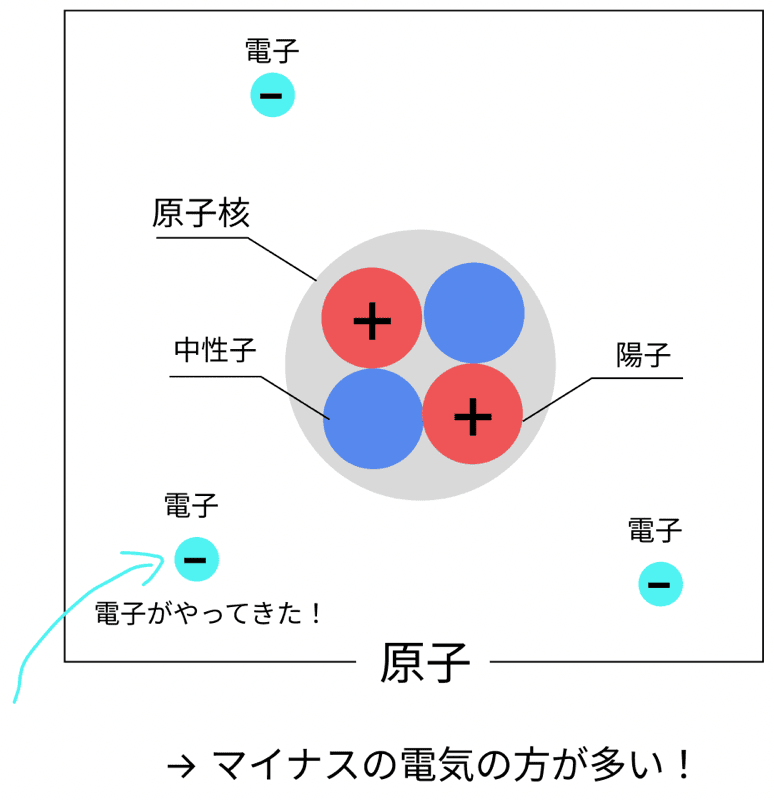
たとえば、塩素原子(Cl)が電子を1個受け取ると…
→ Cl−(陰イオン)になるぞ!
ここで、ちょっとイメージしやすい例え話をしよう!
あるクラスに男子10人・女子10人いたとする。
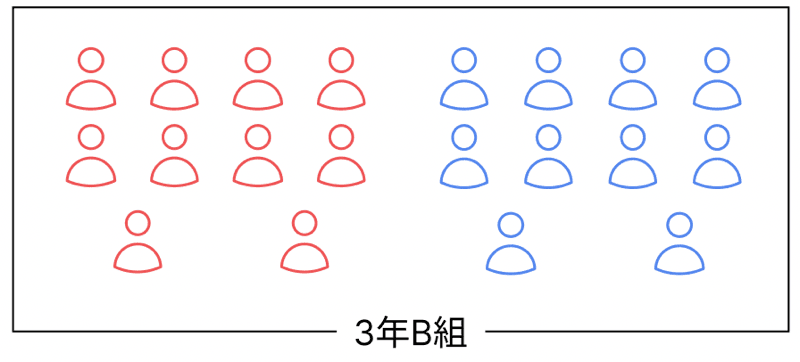
このとき、クラスはちょうどよく男女比のバランスが取れてる状態だよな?
これが「電気を帯びていない原子(中性)」の状態!
でもさ、突然、男子の転校生が1人やってきたらどうなるよ?
そう、
男子11人、女子10人。
ちょっと男子が多くなって男女比のバランスが崩れたよな?
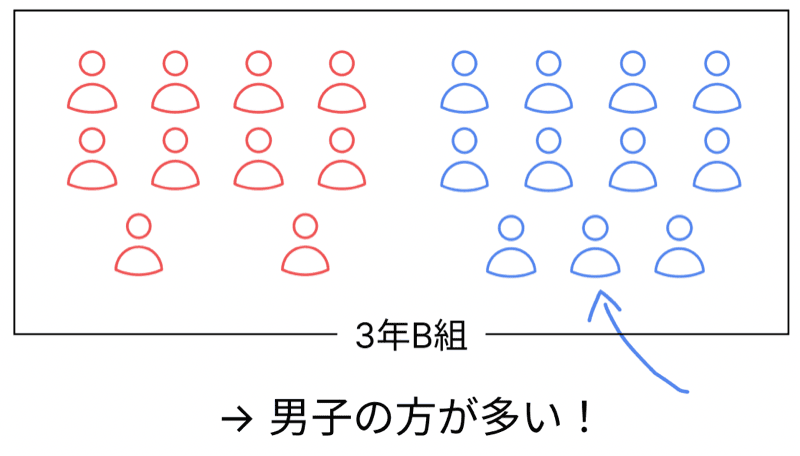
これが、「プラスの電気が多くなった=陽イオン」のイメージ!
逆に、男子が1人、引っ越して別の学校に行ったら?
そう、
男子9人、女子10人。
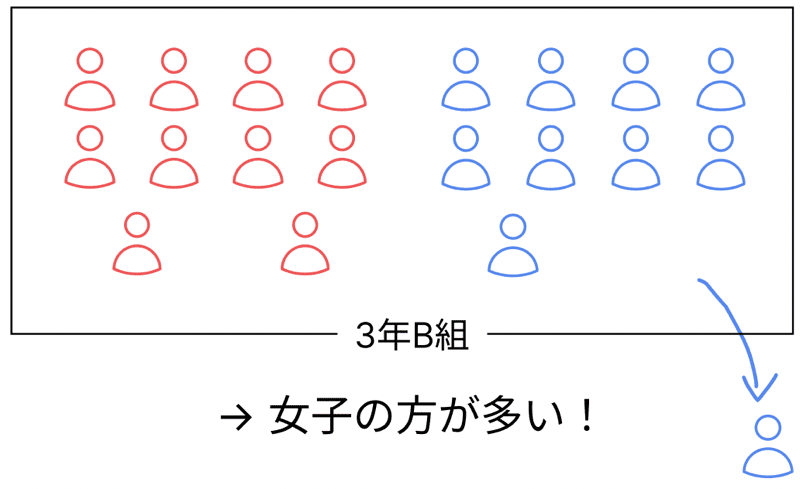
今度は女子の方が多くなって、「マイナスの電気が多い=陰イオン」になる感じ!

次は、イオンを記号で表すイオン式の書き方を見てみようぜ!