【中学理科】果物電池の仕組みをわかりやすく解説

今日は中学理科で出てくる「果物電池」について、分かりやすく解説していくぞ!
まずは定番のレモン電池からいってみよう!
果物電池の代表格「レモン電池」の仕組み
レモンの果汁にはクエン酸がたっぷり含まれている。

この酸が「電解質」としてはたらき、電気を流す準備をしてくれるんだ。
レモンに銅板と亜鉛板を差し込んで導線でつなげば、レモン電池の出来上がり!
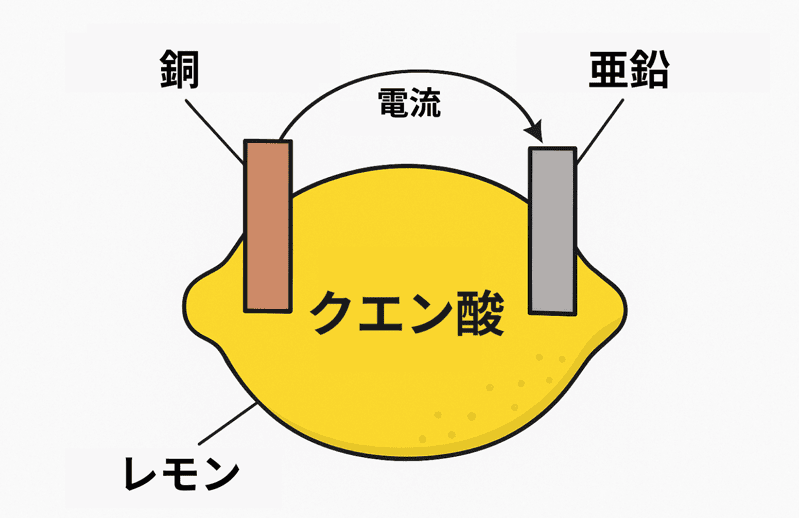
えっ。なぜレモンが電池になるのかって??
それは次のような仕組みだ。
- 亜鉛(Zn)が電子を放出してイオンになる(Zn → Zn²⁺ + 2e⁻)
- 放出された電子が導線を通って銅板へ移動する
- 果汁中の水素イオン(H⁺)が電子を受け取り、水素ガスが発生する
この電子の流れこそが電流さ。
つまり、レモンの酸と2種類の金属がそろえば、電気を取り出せるってことさ!
果物電池の仕組みのポイントは?
果物電池はどの果物でも基本の仕組みは同じさ。
「酸を含む果汁」+「異なる2種類の金属板」で電気が生まれるんだ。
ただし、果物ごとに酸の種類や濃さが違うから、電圧や持続時間に差が出るんだな。
ズバリ、酸っぱい果物ほど電池に向いているぞ。
逆に、酸が少ない果物は電流が弱すぎて電池としてはイマイチなんだ。
| 果物 | 電池にできる? | ポイント |
|---|---|---|
| レモン | ◎ | クエン酸が多く、電圧が安定 |
| グレープフルーツ | ◎ | 果汁が多く、レモンと同じ仕組みで使いやすい |
| キウイ | ◎ | 酸味が強く、電流も比較的安定 |
| オレンジ・みかん | ○ | 酸が少なめなので電圧は弱い |
| トマト | ○ | グルタミン酸や有機酸で電池になる |
| りんご | ○ | リンゴ酸がはたらくが酸は弱め |
| バナナ | △ | 酸が少なく、ほとんど電流が流れない |
| メロン | △ | 甘みが強いが酸が少ないため不向き |
なぜ酸が電解質なの?
それはね……酸は水に溶けるとイオンに分かれるからさ。
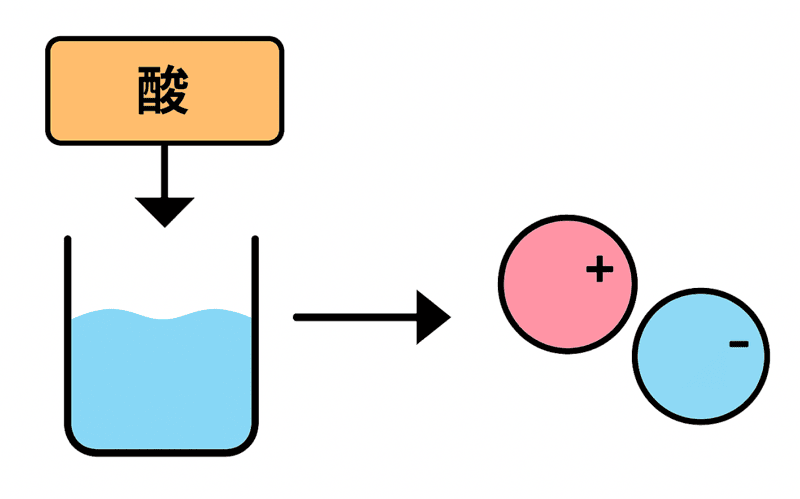
電解質っていうのは、
水に溶けてイオンになり、電流を流すことができる物質のこと
だったな。
酸の正体をもう少し見てみよう。
酸の例:塩酸(HCl)
水に溶けると次のように分かれる。
HCl → H+ + Cl−
水素イオン(H+)と塩化物イオン(Cl−)に分かれるから、電気を運ぶことができるんだ。
酸の例:クエン酸(C₆H₈O₇)
レモンやグレープフルーツに含まれるクエン酸も同じ。
水に溶けるとH+(水素イオン)を出して、残りが陰イオンになる。
クエン酸 → H⁺ + (残りの陰イオン)

なぜ果物電池に銅が使われるの?
あれ・・・銅って何もしてない・・・・?
いいところに気がついたな!
実はそこに重要な理由があるんだ。
結論からいうと……
銅はほとんど何もしないから選ばれているんだ。
「えっ、何もしないなら意味ないじゃん!」って思うかもしれないけど、逆なんだな。
銅が選ばれる理由は次の通り。
- 銅はイオンになりにくい(=電子を出さない)
- だから溶け出したり、ボロボロになったりしない
- その結果、電子の受け渡しの「舞台」として安定して使える
もし銅の代わりに、電子を出しやすい金属を使ったら……
その金属まで反応しちゃって、電池として成り立たなくなるんだ。
だからこそ、「何もしない=安定している」銅が選ばれているんだよ。
たとえ話ならこんな感じだ ↓
- 亜鉛 = 盛り上げ役(どんどん電子を出す)
- レモンの果汁のH+ = 欲しがり役(電子を受け取って水素になる)
- 銅 = 舞台監督(自分は動かず、やり取りを成立させる)

まとめ
- 果物電池の仕組みは「酸が電解質としてはたらき、金属の電子移動で電流が流れる」
- 酸っぱい果物ほど電池向き!
- レモンやグレープフルーツが定番、バナナやメロンは不向き

自由研究にもバッチリ使えるテーマだから、ぜひ自分でも試してみてくれよ!



