【中学理科】イオン式の書き方を完全マスター!覚え方・ルール・例付きで解説

おっす、月縄だ!パンダの妖精だけど、化学もイケるぜ!
「イオン式」って、どうやって書けばいいんだ…!?
「記号の右上に+とか−とか書けっていうけど、実際どれがどれかわかりにくい…!」
そんなキミのために、今回は中学理科で習う「イオン式の書き方」をわかりやすくまとめていくぞ!
イオン式とは何もの?
イオン式とは、イオンになった原子や原子の集まりを記号で表したもののことだ!
たとえば、ナトリウム(Na)が電子を1個失ったとする。
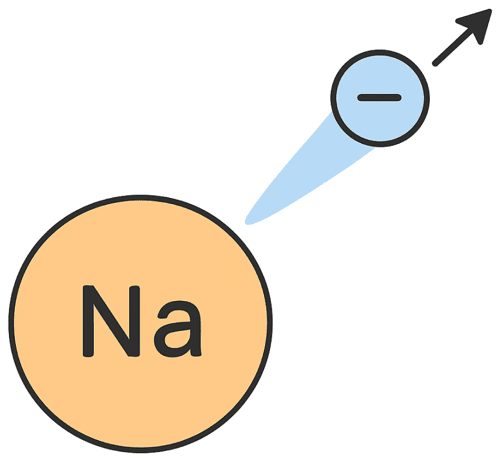
そのときのイオン式はこれだ ↓
Na+
イオン式の書き方のルール
イオン式は次のルールで書いていくぞ。
陽イオン(+)
- 電子を失ったときにできる
- 英文字の右上に「+」を書く
例:
Na → Na+
Ca → Ca2+
陰イオン(−)
- 電子を受け取ったときにできる
- 英文字の右上に「−」を書く
例:
Cl → Cl−
O → O2−
数字は何?
右上の数に注目してくれ!
この数字たちはズバリ、
普通の原子がイオンになる時にやりとりした電子の数さ!
2個電子を失ったら2を書くし、3つゲットしたら3を書くんだ。
| 元素名 | イオン式 | 意味 |
|---|---|---|
| ナトリウム | Na+ | 電子を1個失った |
| カルシウム | Ca2+ | 電子を2個失った |
| 塩素 | Cl− | 電子を1個受け取った |
| 酸素 | O2− | 電子を2個受け取った |
でも、1の場合は数字の1を書かない点に注意しような。これは数学のお作法と一緒って覚えておこう。
多原子イオンにも注意!
ここまで出てきたイオンは、1つの原子が電子をやりとりしてできたもの(単原子イオン)だったよな。
でも、イオンの世界にはもう1つ重要な仲間がいる。それが多原子イオンだ!
多原子イオンとは、
2個以上の原子が結びついて1つのグループになり、全体として電気を帯びているイオンのこと。
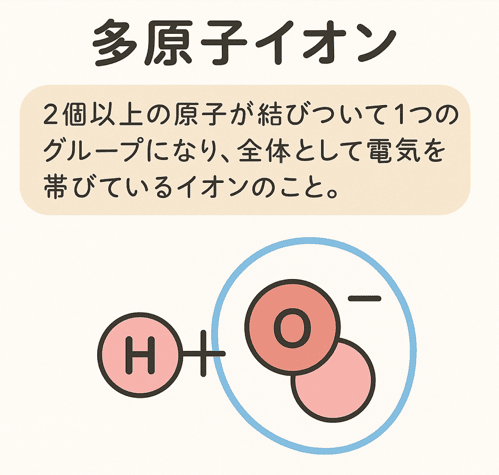
この「原子の集まり」全体が+や−の電気を持っているんだ。
たとえば、水酸化物イオン(OH−)は酸素(O)と水素(H)がセットになってマイナスの電気を帯びている。
硫酸イオン(SO₄2−)は硫黄(S)と酸素(O)がくっついてマイナス2個分の電気を帯びているんだ。
- OH−(水酸化物イオン)… 酸素1つ+水素1つでできていて、全体でマイナス1の電気
- SO₄2−(硫酸イオン)… 硫黄1つ+酸素4つでできていて、全体でマイナス2の電気
多原子イオンのポイントは以下の通りさ。
- 原子同士が化学結合でしっかりつながっている
- グループ全体として電気を持つ(バラすと性質が変わる)
- 化学式の中で括弧を使うことが多い(例:Ca(OH)₂)
テストでは「OH− や SO₄2− は単独の原子じゃない」ってことを理解しておくのが大事だぞ!

多原子イオンは見た目がちょっとややこしいけど、「原子のチーム」って覚えると楽になるぜ!


